Kinesport suit de près les avancées de la littérature scientifique sur la physiologique de la régénération musculaire, afin de proposer le meilleur traitement possible notamment dans la phase initiale de prise en charge. La place de l’inflammation dans cette phase est capitale et dans ce cadre, les équipes de E.Howard et collaborateurs nous proposent dans leur revue de littérature de 2020 publiée dans Frontiers In Phyiology d’élucider ses rôles divergents dans la récupération post lésion musculaires. On vous en propose ici la synthèse et traduction.
Le muscle squelettique endommagé a la capacité intrinsèque de se régénérer et de se réparer par la myogenèse. La réponse myogénique implique l'activation, la prolifération et la différenciation des cellules souches résidant dans les muscles (Les cellules satellites) qui fusionnent finalement les unes avec les autres et avec les fibres existantes pour restaurer les tissus blessés (Dumont et al., 2015; Snijders et al., 2015 ). La capacité de régénération musculaire diminue avec l'âge et avec l’inflammation chronique (Suetta et al., 2013; Jin et al., 2018). La signalisation inflammatoire intramusculaire joue un rôle essentiel dans la médiation de la réponse régénérative suite aux lésions de fibres musculaires, et doit être régulée avec précision sachant que l'expression des cytokines inflammatoires est capable de favoriser la croissance et la fonte musculaire (Dogra et al., 2006, 2007; Munoz-Canoves et al. , 2013). Une augmentation transitoire de la signalisation inflammatoire locale déclenche une cascade de signalisation pro-myogénique qui facilite la réparation, le remodelage et le maintien du tissu musculaire sain. Si cette inflammation intramusculaire persiste de manière chronique, cependant, la capacité de régénération est diminuée et une atrophie musculaire s'ensuit. Une réponse inflammatoire extrêmement élevée aux dommages musculaires limiterait la récupération en empêchant la réparation des tissus endommagés, en favorisant la fonte musculaire et en fin de compte en altérant la restauration de la fonction musculaire.
Cette revue narrative explore les avancées récentes délimitant les rôles opposés de l'inflammation intramusculaire dans la régénération, le maintien et la fonte musculaire. Les facteurs intrinsèques et extrinsèques qui sous-tendent la perte de capacité régénérative avec le vieillissement sont également discutés.
Cette revue narrative explore les avancées récentes délimitant les rôles opposés de l'inflammation intramusculaire dans la régénération, le maintien et la fonte musculaire. Les facteurs intrinsèques et extrinsèques qui sous-tendent la perte de capacité régénérative avec le vieillissement sont également discutés.
RÉGÉNÉRATION DU MUSCLE SQUELETTIQUE
Cellules satellites et myogenèse
La progression des cellules satellites à travers le programme myogénique est déterminée par l'expression séquentielle de facteurs de transcription spécifiques. Pax7 est un facteur de transcription qui est exprimé dans toutes les cellules satellites du muscle mature et qui est essentiel. La progression de la myogénèse implique également Myf5, MyoD, la myogénine et MRF4, des facteurs de transcription connus collectivement sous le nom de facteurs de régulation myogéniques (MRF). Myf5 et MyoD sont exprimés tôt après la blessure (Cornelison et Wold, 1997; Cooper et al., 1999), tandis que la myogénine et le MRF4 se sont avérés réguler les stades ultérieurs de la différenciation myogénique (Smith et al., 1994; Cornelison et Wold, 1997).
Un équilibre précis des mécanismes intracellulaires régulant la quiescence, la différenciation et l'auto-renouvellement est nécessaire pour maintenir la fonction des cellules satellites et leur capacité de régénération. La voie de signalisation NOTCH par exemple, est essentielle à plusieurs processus cellulaires. Elle joue également un rôle dans le maintien de la capacité de quiescence et d'auto-renouvèlement des cellules satellites.
L'autophagie des muscles squelettiques, un processus cellulaire responsable de la dégradation des protéines intracellulaires, des macromolécules et des organites, est essentielle à la régénération des muscles squelettiques. Les déclins de l'activité autophagique liés à l’âge sont associés à une diminution de la capacité de régénération (Garcia-Prat et al., 2016).
Réponse inflammatoire aux lésions musculaires squelettiques
La signalisation pro-inflammatoire aiguë et le recrutement de cellules immunitaires vers le site du traumatisme musculaire constituent la phase initiale de cette réponse inflammatoire. Plusieurs cellules immunitaires sont impliquées dans la réponse régénératrice du muscle squelettique.
Les neutrophiles sont parmi les premières cellules inflammatoires à infiltrer les tissus musculaires lésés. Ils sont observés dès 1 à 3 h après une lésion musculaire, avec un nombre maximum observé 6 à 24 h après une blessure (Fielding et al., 1993; Malm et al., 2000). Ces cellules phagocytaires libèrent des protéases et des oxydants pour faciliter l'élimination des fibres endommagées. Bien que leur présence puisse aggraver les lésions musculaires (Pizza et al., 2005), l'épuisement des neutrophiles retarde la récupération musculaire, suggérant que leur rôle dans l'élimination des débris cellulaires et le recrutement d'autres cellules inflammatoires est essentiel pour une régénération réussie (Teixeira et al., 2003).
Le recrutement temporel et spatial des macrophages est essentiel à la réponse régénératrice musculaire aux blessures. L'inhibition de cette accumulation de monocytes et de macrophages dans les muscles blessés à l'aide de Ccr2 chez la souris et via un traitement pharmacologique altère la réponse régénérative (Summan et al., 2006; Lu et al., 2011). Les macrophages sont initialement polarisés en un phénotype pro-inflammatoire M1 qui sécrète des cytokines pro-inflammatoires (c.-à-d. TNFa, IL-1b, IFN-g) et des espèces réactives de l'oxygène pour faciliter l'élimination des débris cellulaires et le recrutement de cellules immunitaires vers le site de la lésion (Villalta et al., 2009; Dort et al., 2019). Bien qu'un mélange de cellules M1 et M2 ait été observé à la suite d'une blessure (Heredia et al., 2013), un changement du phénotype pro-inflammatoire à anti-inflammatoire des macrophages est essentiel pour la bonne progression de la réponse de régénération. Les cytokines pro-inflammatoires libérées des macrophages M1 stimulent la prolifération des myoblastes, tandis que les cytokines anti-inflammatoires des macrophages M2 favorisent leur différentiation (Arnold et al., 2007). Il a été démontré que la suppression de cette transition phénotypique M1 à M2 atténue la régénération musculaire et réduit la croissance des fibres musculaires (Mounier et al., 2013; Tonkin et al., 2015; Varga et al., 2016).
Le recrutement des lymphocytes T (cellules T) est également essentiel dans la réparation et la régénération des tissus musculaires endommagés, l'infiltration des cellules T CD4 + et CD8 + atteignant un pic environ 3 à 5 jours après la blessure (Fu et al., 2015). Le remodelage transitoire des composants de la matrice extracellulaire (ECM) et la modulation de l'activité des cellules satellites par les cellules FAP (Fibro Adipogenic Progenitors) sont un composant supplémentaire à la réponse régénératrice aux blessures musculaires. Les FAP sont des cellules souches qui peuvent se différencier en fibroblastes ou adipocytes. L'épuisement des FAP nuit à la régénération musculaire après une blessure et entraîne une perte de cellules satellites dans des conditions homéostatiques (Wosczyna et al., 2019).
La progression des cellules satellites à travers le programme myogénique est déterminée par l'expression séquentielle de facteurs de transcription spécifiques. Pax7 est un facteur de transcription qui est exprimé dans toutes les cellules satellites du muscle mature et qui est essentiel. La progression de la myogénèse implique également Myf5, MyoD, la myogénine et MRF4, des facteurs de transcription connus collectivement sous le nom de facteurs de régulation myogéniques (MRF). Myf5 et MyoD sont exprimés tôt après la blessure (Cornelison et Wold, 1997; Cooper et al., 1999), tandis que la myogénine et le MRF4 se sont avérés réguler les stades ultérieurs de la différenciation myogénique (Smith et al., 1994; Cornelison et Wold, 1997).
Un équilibre précis des mécanismes intracellulaires régulant la quiescence, la différenciation et l'auto-renouvellement est nécessaire pour maintenir la fonction des cellules satellites et leur capacité de régénération. La voie de signalisation NOTCH par exemple, est essentielle à plusieurs processus cellulaires. Elle joue également un rôle dans le maintien de la capacité de quiescence et d'auto-renouvèlement des cellules satellites.
L'autophagie des muscles squelettiques, un processus cellulaire responsable de la dégradation des protéines intracellulaires, des macromolécules et des organites, est essentielle à la régénération des muscles squelettiques. Les déclins de l'activité autophagique liés à l’âge sont associés à une diminution de la capacité de régénération (Garcia-Prat et al., 2016).
Réponse inflammatoire aux lésions musculaires squelettiques
La signalisation pro-inflammatoire aiguë et le recrutement de cellules immunitaires vers le site du traumatisme musculaire constituent la phase initiale de cette réponse inflammatoire. Plusieurs cellules immunitaires sont impliquées dans la réponse régénératrice du muscle squelettique.
Les neutrophiles sont parmi les premières cellules inflammatoires à infiltrer les tissus musculaires lésés. Ils sont observés dès 1 à 3 h après une lésion musculaire, avec un nombre maximum observé 6 à 24 h après une blessure (Fielding et al., 1993; Malm et al., 2000). Ces cellules phagocytaires libèrent des protéases et des oxydants pour faciliter l'élimination des fibres endommagées. Bien que leur présence puisse aggraver les lésions musculaires (Pizza et al., 2005), l'épuisement des neutrophiles retarde la récupération musculaire, suggérant que leur rôle dans l'élimination des débris cellulaires et le recrutement d'autres cellules inflammatoires est essentiel pour une régénération réussie (Teixeira et al., 2003).
Le recrutement temporel et spatial des macrophages est essentiel à la réponse régénératrice musculaire aux blessures. L'inhibition de cette accumulation de monocytes et de macrophages dans les muscles blessés à l'aide de Ccr2 chez la souris et via un traitement pharmacologique altère la réponse régénérative (Summan et al., 2006; Lu et al., 2011). Les macrophages sont initialement polarisés en un phénotype pro-inflammatoire M1 qui sécrète des cytokines pro-inflammatoires (c.-à-d. TNFa, IL-1b, IFN-g) et des espèces réactives de l'oxygène pour faciliter l'élimination des débris cellulaires et le recrutement de cellules immunitaires vers le site de la lésion (Villalta et al., 2009; Dort et al., 2019). Bien qu'un mélange de cellules M1 et M2 ait été observé à la suite d'une blessure (Heredia et al., 2013), un changement du phénotype pro-inflammatoire à anti-inflammatoire des macrophages est essentiel pour la bonne progression de la réponse de régénération. Les cytokines pro-inflammatoires libérées des macrophages M1 stimulent la prolifération des myoblastes, tandis que les cytokines anti-inflammatoires des macrophages M2 favorisent leur différentiation (Arnold et al., 2007). Il a été démontré que la suppression de cette transition phénotypique M1 à M2 atténue la régénération musculaire et réduit la croissance des fibres musculaires (Mounier et al., 2013; Tonkin et al., 2015; Varga et al., 2016).
Le recrutement des lymphocytes T (cellules T) est également essentiel dans la réparation et la régénération des tissus musculaires endommagés, l'infiltration des cellules T CD4 + et CD8 + atteignant un pic environ 3 à 5 jours après la blessure (Fu et al., 2015). Le remodelage transitoire des composants de la matrice extracellulaire (ECM) et la modulation de l'activité des cellules satellites par les cellules FAP (Fibro Adipogenic Progenitors) sont un composant supplémentaire à la réponse régénératrice aux blessures musculaires. Les FAP sont des cellules souches qui peuvent se différencier en fibroblastes ou adipocytes. L'épuisement des FAP nuit à la régénération musculaire après une blessure et entraîne une perte de cellules satellites dans des conditions homéostatiques (Wosczyna et al., 2019).
CONSÉQUENCES POTENTIELLES DE LA SIGNALISATION INFLAMMATOIRE INTRAMUSCULAIRE RENFORCÉE
Des niveaux basaux élevés (pré-blessure ou pré-chirurgie) d'inflammation intramusculaire, une réponse inflammatoire exagérée aux dommages musculaires, ou les deux, conduiraient à des niveaux excessivement élevés d'inflammation musculaire qui peuvent perturber cette réponse finement régulée. De même, l'échec à résoudre la signalisation pro-inflammatoire persistante après une blessure musculaire peut déréguler la régénération et la réparation musculaire.
Ainsi par exemple une infection chronique du muscle squelettique de souris (c'est-à-dire un environnement inflammatoire préexistant) retarde la réparation musculaire après une lésion de cardiotoxine (Jin et al., 2018). L'environnement inflammatoire accru du muscle infecté semble limiter la transition du phénotype des macrophages et altère l'expression des MRF à la suite de dommages (Jin et al., 2018). Un passage retardé des macrophages pro-inflammatoires aux pro-régénérateurs peut également favoriser la fibrose. La signalisation persistante des cytokines pro-inflammatoires peut favoriser la fonte musculaire en atténuant la synthèse des protéines musculaires et en déclenchant la dégradation des protéines musculaires. Les rôles régulateurs opposés de la signalisation inflammatoire locale dans la myogenèse et le maintien de la masse musculaire indiquent que la réponse inflammatoire post-lésion ou post-opératoire doit être bien contrôlée pour maintenir la masse musculaire et permettre une régénération tissulaire adéquate. Alors que plusieurs cytokines sont impliquées dans la régulation de ces processus, TWEAK, TNFa, IL-6 et leurs voies moléculaires respectives semblent être partagées entre les conditions d'inflammation aiguë et chronique.
Rôles divergents de l'inflammation dans la myogenèse
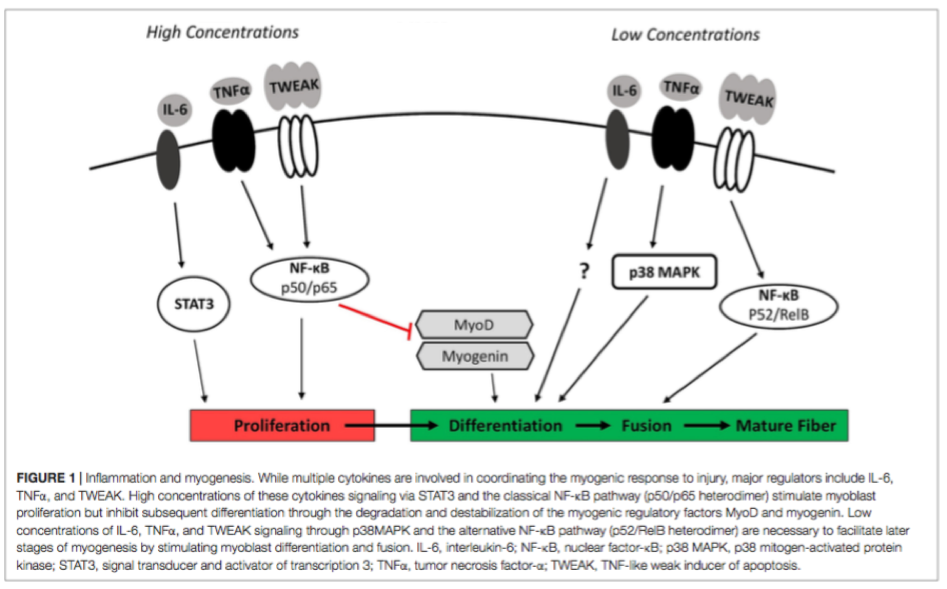
Les rôles opposés de l'inflammation dans la promotion et l'inhibition de la myogenèse correspondent aux effets observés en fonction de la concentration et du temps de plusieurs cytokines inflammatoires dans des modèles cellulaires et animaux (figure 1). TWEAK, par exemple, est une cytokine produite par plusieurs types de cellules (c'est-à-dire les macrophages et le muscle squelettique) qui est capable de moduler la myogenèse (Mittal et al., 2010)
Ainsi par exemple une infection chronique du muscle squelettique de souris (c'est-à-dire un environnement inflammatoire préexistant) retarde la réparation musculaire après une lésion de cardiotoxine (Jin et al., 2018). L'environnement inflammatoire accru du muscle infecté semble limiter la transition du phénotype des macrophages et altère l'expression des MRF à la suite de dommages (Jin et al., 2018). Un passage retardé des macrophages pro-inflammatoires aux pro-régénérateurs peut également favoriser la fibrose. La signalisation persistante des cytokines pro-inflammatoires peut favoriser la fonte musculaire en atténuant la synthèse des protéines musculaires et en déclenchant la dégradation des protéines musculaires. Les rôles régulateurs opposés de la signalisation inflammatoire locale dans la myogenèse et le maintien de la masse musculaire indiquent que la réponse inflammatoire post-lésion ou post-opératoire doit être bien contrôlée pour maintenir la masse musculaire et permettre une régénération tissulaire adéquate. Alors que plusieurs cytokines sont impliquées dans la régulation de ces processus, TWEAK, TNFa, IL-6 et leurs voies moléculaires respectives semblent être partagées entre les conditions d'inflammation aiguë et chronique.
Rôles divergents de l'inflammation dans la myogenèse
Les rôles opposés de l'inflammation dans la promotion et l'inhibition de la myogenèse correspondent aux effets observés en fonction de la concentration et du temps de plusieurs cytokines inflammatoires dans des modèles cellulaires et animaux (figure 1). TWEAK, par exemple, est une cytokine produite par plusieurs types de cellules (c'est-à-dire les macrophages et le muscle squelettique) qui est capable de moduler la myogenèse (Mittal et al., 2010)

Des concentrations élevées de TWEAK améliorant la prolifération et inhibant la différenciation par la signalisation NF-kB classique seraient essentielles pendant les premières phases de la régénération musculaire pour favoriser une prolifération rapide et une expansion adéquate de la population de myoblastes, tout en évitant simultanément une différenciation prématurée (Enwere et al., 2014 ). En revanche, il a été démontré que TWEAK présent à de faibles concentrations (10 ng / ml) dans les myoblastes C2C12 favorise les stades ultérieurs de la myogenèse par l'activation de la signalisation alternative (non canonique) NF-kB (Enwere et al., 2012).
La cytokine TNFa régule également la myogenèse. Les concentrations initialement élevées de TNFa jouent également un rôle dans la promotion de la prolifération (Li, 2003) et l'inhibition de la différenciation myogénique (Langen et al., 2004).
La cytokine IL-6 est un autre régulateur majeur de la myogenèse. L'IL-6 est sécrétée par l'infiltration des macrophages et des neutrophiles, des cellules FAP et du muscle lui-même (Kami et Senba, 1998; Joe et al., 2010; Zhang et al., 2013) L'IL-6 est également nécessaire pour la différenciation complète des cellules musculaires.
Quoi qu'il en soit, ces résultats suggèrent collectivement qu'une augmentation transitoire de la signalisation intramusculaire pro-inflammatoire après une blessure est nécessaire pour la régénération et la réparation musculaire, tandis qu'une réponse inflammatoire excessive ou persistante peut empêcher la myogenèse et limiter la récupération.
L'inflammation module le Turn Over des protéines musculaires
Une expression excessivement élevée ou chronique de cytokines pro-inflammatoires suite à une blessure musculaire altère la récupération en favorisant la fonte musculaire (figure 2).
Les souris soumises à l'administration chronique de TWEAK soluble présentent un diamètre de sections de fibres musculaires réduit et une diminution du poids corporel par rapport aux souris témoins (Dogra et al., 2007).
Des niveaux élevés de TNFa modulent le renouvellement des protéines musculaires et induisent une atrophie. Une perte dose-dépendante de protéines totales a été notée dans les myotubes musculaires squelettiques différenciés après une exposition prolongée au TNFa (1 à 6 ng / mL) (Li et Reid, 2000).
Les effets d'une expression accrue de l'IL-6 sur les voies de signalisation anabolique et catabolique musculaire in vivo restent insaisissables. La perfusion locale d'IL-6 soluble dans les muscles des rats a significativement diminué la teneur en protéines myofibrillaires par rapport au muscle controlatéral non traité (Haddad et al., 2005).
La cytokine TNFa régule également la myogenèse. Les concentrations initialement élevées de TNFa jouent également un rôle dans la promotion de la prolifération (Li, 2003) et l'inhibition de la différenciation myogénique (Langen et al., 2004).
La cytokine IL-6 est un autre régulateur majeur de la myogenèse. L'IL-6 est sécrétée par l'infiltration des macrophages et des neutrophiles, des cellules FAP et du muscle lui-même (Kami et Senba, 1998; Joe et al., 2010; Zhang et al., 2013) L'IL-6 est également nécessaire pour la différenciation complète des cellules musculaires.
Quoi qu'il en soit, ces résultats suggèrent collectivement qu'une augmentation transitoire de la signalisation intramusculaire pro-inflammatoire après une blessure est nécessaire pour la régénération et la réparation musculaire, tandis qu'une réponse inflammatoire excessive ou persistante peut empêcher la myogenèse et limiter la récupération.
L'inflammation module le Turn Over des protéines musculaires
Une expression excessivement élevée ou chronique de cytokines pro-inflammatoires suite à une blessure musculaire altère la récupération en favorisant la fonte musculaire (figure 2).
Les souris soumises à l'administration chronique de TWEAK soluble présentent un diamètre de sections de fibres musculaires réduit et une diminution du poids corporel par rapport aux souris témoins (Dogra et al., 2007).
Des niveaux élevés de TNFa modulent le renouvellement des protéines musculaires et induisent une atrophie. Une perte dose-dépendante de protéines totales a été notée dans les myotubes musculaires squelettiques différenciés après une exposition prolongée au TNFa (1 à 6 ng / mL) (Li et Reid, 2000).
Les effets d'une expression accrue de l'IL-6 sur les voies de signalisation anabolique et catabolique musculaire in vivo restent insaisissables. La perfusion locale d'IL-6 soluble dans les muscles des rats a significativement diminué la teneur en protéines myofibrillaires par rapport au muscle controlatéral non traité (Haddad et al., 2005).
VARIABILITÉ DE LA CAPACITÉ RÉGÉNÉRATIVE MUSCULAIRE
L'activation des cellules satellites et leur prolifération, différentiation et fusion subséquentes avec les myofibres existantes sont essentielles après une lésion musculaire pour régénérer le tissu musculaire endommagé. Cependant, les diminutions liées à l'âge de l'expansion des cellules progénitrices et le maintien inadéquat de la quiescence des cellules satellites altèrent la capacité de régénération musculaire chez les personnes âgées.
Plusieurs processus moléculaires et cellulaires (intrinsèques et extrinsèques) sont à l'origine de la perte de capacité régénérative avec le vieillissement. La voie de signalisation NOTCH dans les muscles jeunes favorise la prolifération des cellules satellites activées, tandis qu'une suppression ultérieure de cette voie et une transition vers la signalisation canonique Wnt sont nécessaires pour une différentiation et une croissance musculaire appropriées (Conboy et Rando, 2002; Brack et al., 2008). Le vieillissement semble perturber l'équilibre précis et l'interaction de ces voies, car l'activité Notch est atténuée dans les muscles âgés (Conboy et al., 2003). Les cellules satellites isolées de souris âgées présentent également des niveaux élevés de signalisation Wnt qui atténuent la progression des cellules satellites grâce au programme de différentiation et favorisent leur adoption d'un profil fibrogène (Brack et al., 2007). Des travaux récents ont suggéré que les déficiences liées à l'âge dans la myogénèse sont également liées au déclin de l'autophagie, ce qui provoque une détérioration fonctionnelle des cellules satellites et favorise la sénescence (Garcia-Prat et al., 2016).
Les augmentations liées à l'âge de l'activité de la voie inflammatoire intramusculaire peuvent également réduire le potentiel de régénération musculaire avec le vieillissement. Les travaux sur les animaux ont indiqué que l'atténuation de l'activité de la voie IL-6 / JAK / STAT3 améliore le potentiel de régénération des cellules satellites âgées (Price et al., 2014).
Les niveaux basaux d'inflammation et la sensibilité aux stimuli inflammatoires peuvent ne pas être uniformes dans toutes les populations. Les travaux de suivi de Bamman et al. (2015) ont décrit des analyses identifiant le phénotype MuIS (+) chez certains adultes de tous âges, suggérant que certains individus présentent des niveaux basaux élevés d'inflammation musculaire et une réponse exagérée ou prolongée à une agression inflammatoire. Cette variabilité interindividuelle apparente de la sensibilité accrue à l'inflammation suggère que certaines personnes peuvent être plus sujettes à une réponse inflammatoire extrêmement élevée à une lésion musculaire qui serait préjudiciable à la récupération.
Le phénotype MuIS (+) et les déclins liés à l'âge de la capacité de régénération peuvent avoir des implications dans le contexte d'une lésion musculaire, étant donné l'atrophie et / ou les dommages associés à la défaillance musculaire qui nécessitent une période de croissance musculaire pour une récupération correcte. De courtes périodes d'immobilisation ou une activité physique réduite sont souvent nécessaires après une blessure ou en postopératoire pour éviter d'autres blessures et faciliter la récupération. Alors que restreindre le mouvement permet à la zone blessée de guérir, la fonte musculaire peut se produire rapidement dans ces conditions étant donné la diminution de la charge et l'absence d'activation neurale (c'est-à-dire une atrophie de non utilisation). Bien que l'implication des cellules satellites dans la régénération des fibres musculaires ait été constamment démontrée, le rôle des cellules satellites dans l'hypertrophie des fibres musculaires et les effets du vieillissement sont moins clairs. Enfin, il serait nécessaire d'identifier des stratégies thérapeutiques appropriées pour favoriser la récupération fonctionnelle et l'accumulation de masse musculaire chez les individus avec le phénotype MuIS (+). Les interventions potentielles peuvent inclure une réadaptation physique plus agressive (Bamman et al., 2015) ou un traitement pharmacologique pour atténuer l'inflammation excessive.
L'élucidation du timing et des objectifs appropriés pour les interventions pharmacologiques serait essentiel. Atténuer l'inflammation trop tôt dans le processus de régénération peut retarder ou diminuer la récupération. De même, le ciblage de la signalisation pro-inflammatoire ou anti-inflammatoire, en particulier, peut perturber l'équilibre délicat de ces voies nécessaires à une régénération appropriée.
Plusieurs processus moléculaires et cellulaires (intrinsèques et extrinsèques) sont à l'origine de la perte de capacité régénérative avec le vieillissement. La voie de signalisation NOTCH dans les muscles jeunes favorise la prolifération des cellules satellites activées, tandis qu'une suppression ultérieure de cette voie et une transition vers la signalisation canonique Wnt sont nécessaires pour une différentiation et une croissance musculaire appropriées (Conboy et Rando, 2002; Brack et al., 2008). Le vieillissement semble perturber l'équilibre précis et l'interaction de ces voies, car l'activité Notch est atténuée dans les muscles âgés (Conboy et al., 2003). Les cellules satellites isolées de souris âgées présentent également des niveaux élevés de signalisation Wnt qui atténuent la progression des cellules satellites grâce au programme de différentiation et favorisent leur adoption d'un profil fibrogène (Brack et al., 2007). Des travaux récents ont suggéré que les déficiences liées à l'âge dans la myogénèse sont également liées au déclin de l'autophagie, ce qui provoque une détérioration fonctionnelle des cellules satellites et favorise la sénescence (Garcia-Prat et al., 2016).
Les augmentations liées à l'âge de l'activité de la voie inflammatoire intramusculaire peuvent également réduire le potentiel de régénération musculaire avec le vieillissement. Les travaux sur les animaux ont indiqué que l'atténuation de l'activité de la voie IL-6 / JAK / STAT3 améliore le potentiel de régénération des cellules satellites âgées (Price et al., 2014).
Les niveaux basaux d'inflammation et la sensibilité aux stimuli inflammatoires peuvent ne pas être uniformes dans toutes les populations. Les travaux de suivi de Bamman et al. (2015) ont décrit des analyses identifiant le phénotype MuIS (+) chez certains adultes de tous âges, suggérant que certains individus présentent des niveaux basaux élevés d'inflammation musculaire et une réponse exagérée ou prolongée à une agression inflammatoire. Cette variabilité interindividuelle apparente de la sensibilité accrue à l'inflammation suggère que certaines personnes peuvent être plus sujettes à une réponse inflammatoire extrêmement élevée à une lésion musculaire qui serait préjudiciable à la récupération.
Le phénotype MuIS (+) et les déclins liés à l'âge de la capacité de régénération peuvent avoir des implications dans le contexte d'une lésion musculaire, étant donné l'atrophie et / ou les dommages associés à la défaillance musculaire qui nécessitent une période de croissance musculaire pour une récupération correcte. De courtes périodes d'immobilisation ou une activité physique réduite sont souvent nécessaires après une blessure ou en postopératoire pour éviter d'autres blessures et faciliter la récupération. Alors que restreindre le mouvement permet à la zone blessée de guérir, la fonte musculaire peut se produire rapidement dans ces conditions étant donné la diminution de la charge et l'absence d'activation neurale (c'est-à-dire une atrophie de non utilisation). Bien que l'implication des cellules satellites dans la régénération des fibres musculaires ait été constamment démontrée, le rôle des cellules satellites dans l'hypertrophie des fibres musculaires et les effets du vieillissement sont moins clairs. Enfin, il serait nécessaire d'identifier des stratégies thérapeutiques appropriées pour favoriser la récupération fonctionnelle et l'accumulation de masse musculaire chez les individus avec le phénotype MuIS (+). Les interventions potentielles peuvent inclure une réadaptation physique plus agressive (Bamman et al., 2015) ou un traitement pharmacologique pour atténuer l'inflammation excessive.
L'élucidation du timing et des objectifs appropriés pour les interventions pharmacologiques serait essentiel. Atténuer l'inflammation trop tôt dans le processus de régénération peut retarder ou diminuer la récupération. De même, le ciblage de la signalisation pro-inflammatoire ou anti-inflammatoire, en particulier, peut perturber l'équilibre délicat de ces voies nécessaires à une régénération appropriée.
CONCLUSION
Le muscle squelettique a la capacité intrinsèque de se régénérer et de se réparer à la suite d'une blessure grâce à la myogenèse, un processus régulé par une réponse inflammatoire finement contrôlée. Cette capacité de régénération diminue cependant avec l'âge, car des altérations de la signalisation intrinsèque et extrinsèque régulant l'activité des cellules satellites sont observées chez les personnes âgées. Les modèles cellulaires et animaux montrent également que, tandis que la signalisation inflammatoire intervient dans la réponse myogénique aux lésions musculaires, des concentrations élevées de plusieurs cytokines inflammatoires (par exemple, TNFa, IL-6, TWEAK) peuvent inhiber la régénération musculaire et déclencher une fonte musculaire. Par conséquent, un âge avancé et / ou une signalisation inflammatoire extrêmement élevée post-blessure ou postopératoire peuvent limiter la réparation des tissus endommagés et le maintien de la masse musculaire. Une inflammation excessive ou chronique est une préoccupation particulière pour un sous-ensemble d'individus qui présentent des niveaux élevés de signalisation inflammatoire intramusculaire basale et une plus grande sensibilité à une agression inflammatoire (c'est-à-dire le phénotype MuIS (+)). Une exploration future de cette variabilité interindividuelle de la sensibilité inflammatoire, en se concentrant sur la compréhension de la cause des différences observées, est justifiée.
À ce jour, on en sait moins sur les rôles divergents de la signalisation inflammatoire à la suite d'une lésion musculaire chez l'homme. Des investigations supplémentaires sont nécessaires pour délimiter le rôle de l'inflammation aiguë par rapport à l'inflammation chronique en tant que stimulus anabolique ou catabolique, respectivement. Les travaux futurs doivent également se concentrer sur les facteurs moléculaires et cellulaires sous-jacents à la perte de capacité régénérative avec le vieillissement. La compréhension de ces processus est essentielle dans le développement d'interventions cliniques pour augmenter la régénération musculaire et atténuer l'atrophie musculaire après une blessure musculaire.
À ce jour, on en sait moins sur les rôles divergents de la signalisation inflammatoire à la suite d'une lésion musculaire chez l'homme. Des investigations supplémentaires sont nécessaires pour délimiter le rôle de l'inflammation aiguë par rapport à l'inflammation chronique en tant que stimulus anabolique ou catabolique, respectivement. Les travaux futurs doivent également se concentrer sur les facteurs moléculaires et cellulaires sous-jacents à la perte de capacité régénérative avec le vieillissement. La compréhension de ces processus est essentielle dans le développement d'interventions cliniques pour augmenter la régénération musculaire et atténuer l'atrophie musculaire après une blessure musculaire.
Article original : Howard EE, Pasiakos SM, Blesso CN, Fussell MA and Rodriguez NR (2020) Divergent Roles of Inflammation in Skeletal Muscle Recovery From Injury. Front. Physiol. 11:87. doi: 10.3389/fphys.2020.00087



 Rôles divergents de l'inflammation dans la récupération après lésion musculaire
Rôles divergents de l'inflammation dans la récupération après lésion musculaire