INTRODUCTION :
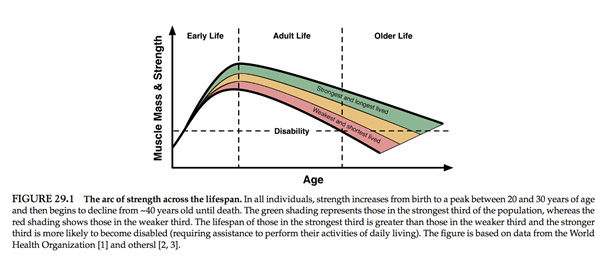
La masse musculaire représente environ 45% du poids du corps, ce qui en fait le tissu le plus abondant du corps humain. La masse musculaire varie considérablement durant la vie (Figure 29.1), elle augmente tout comme la force jusqu’à 20 ans, puis après avoir atteint un pic elle commence à décliner à partir de la quatrième décennie. En raison de son rôle central dans l’activité et le métabolisme, la masse musculaire est également un facteur prédictif de la longévité humaine. En effet le tiers de la population le plus fort a 2,5 fois plus de chance de passer 100 ans par rapport au reste de la population.
Le muscle est un tissu qui répond également à l’environnement nutritionnel. Un exercice d’une fréquence, intensité et durée suffisantes peut augmenter la masse musculaire, alors qu’un arrêt de l’exercice diminuerait la masse musculaire. Dans cet article l’accent est mis sur le rôle de la nutrition pour compléter le travail de force et d’hypertrophie musculaire.
La force musculaire est déterminée par la CSA (Cross Sectional Area, soit l’aire du muscle à la coupe transversale), le contrôle neural et la capacité à transférer la force. La CSA est déterminée par l’équilibre de la synthèse (MPS) et de la dégradation (MPB) des protéines. Lorsque la synthèse des protéines musculaires est supérieur à sa dégradation, le muscle ajoute des sarcomères en parallèles entrainant le processus d’hypertrophie musculaire. L’objectif de cet article est de déterminer les interventions nutritionnelles qui favorisent l’augmentation de la masse musculaire qui se produit avec un entrainement de force.
Le muscle est un tissu qui répond également à l’environnement nutritionnel. Un exercice d’une fréquence, intensité et durée suffisantes peut augmenter la masse musculaire, alors qu’un arrêt de l’exercice diminuerait la masse musculaire. Dans cet article l’accent est mis sur le rôle de la nutrition pour compléter le travail de force et d’hypertrophie musculaire.
La force musculaire est déterminée par la CSA (Cross Sectional Area, soit l’aire du muscle à la coupe transversale), le contrôle neural et la capacité à transférer la force. La CSA est déterminée par l’équilibre de la synthèse (MPS) et de la dégradation (MPB) des protéines. Lorsque la synthèse des protéines musculaires est supérieur à sa dégradation, le muscle ajoute des sarcomères en parallèles entrainant le processus d’hypertrophie musculaire. L’objectif de cet article est de déterminer les interventions nutritionnelles qui favorisent l’augmentation de la masse musculaire qui se produit avec un entrainement de force.

Protéine :
C’est l’intervention nutritionnelle avec le plus de preuve à l’appui concernant l’amélioration de la masse musculaire. Dans une méta analyse Cermak et coll. ont analysés 22 ECR comparant la supplémentation en protéine avec un placebo chez 680 sujets. La supplémentation augmente la masse musculaire (0,81 kg pour les plus jeunes et 0,48 chez les plus vieux) et la force (1RM augmenté de 14,4 kg chez les plus jeunes et 13,1 kg chez les plus vieux). L’augmentation est indépendante du niveau d’entrainement des sportifs. La supplémentation en protéine, en particulier en acides aminés essentiels (EAA) est nécessaire pour augmenter la balance nette en protéine après l’exercice. Les travaux comparant les effets des différents types de protéines sur la synthèse de protéine musculaire (MPS : muscle protein synthesis) ont montré que les protéines les plus facilement digestibles et riches en acides aminés à chaine ramifiée (BCAA) notamment la leucine sont ceux qui entrainent une meilleure MPS. Moore et coll. ont décrit la relation entre la quantité de protéines et la MPS, dans une étude il a montré que la consommation croissante de protéines d’œuf après l’exercice de la jambe entraine une dose-réponse de la MPS chez l’homme avec un plafond à 0,25g/kg de poids corporel. D’autres études conseillent des apport plus importants (0,4g/kg) chez les personnes âgées, les sports de force…
C’est l’intervention nutritionnelle avec le plus de preuve à l’appui concernant l’amélioration de la masse musculaire. Dans une méta analyse Cermak et coll. ont analysés 22 ECR comparant la supplémentation en protéine avec un placebo chez 680 sujets. La supplémentation augmente la masse musculaire (0,81 kg pour les plus jeunes et 0,48 chez les plus vieux) et la force (1RM augmenté de 14,4 kg chez les plus jeunes et 13,1 kg chez les plus vieux). L’augmentation est indépendante du niveau d’entrainement des sportifs. La supplémentation en protéine, en particulier en acides aminés essentiels (EAA) est nécessaire pour augmenter la balance nette en protéine après l’exercice. Les travaux comparant les effets des différents types de protéines sur la synthèse de protéine musculaire (MPS : muscle protein synthesis) ont montré que les protéines les plus facilement digestibles et riches en acides aminés à chaine ramifiée (BCAA) notamment la leucine sont ceux qui entrainent une meilleure MPS. Moore et coll. ont décrit la relation entre la quantité de protéines et la MPS, dans une étude il a montré que la consommation croissante de protéines d’œuf après l’exercice de la jambe entraine une dose-réponse de la MPS chez l’homme avec un plafond à 0,25g/kg de poids corporel. D’autres études conseillent des apport plus importants (0,4g/kg) chez les personnes âgées, les sports de force…
Acide aminé ramifié (BCAA) :
La leucine joue un rôle important dans l’augmentation de la MPS après l’exercice, beaucoup se sont donc demandé si les BCAA pouvaient réguler la taille et la force musculaire mieux que le protéines complètes. Les BCAA (leucine, isoleucine et valine) sont trois des 9 acides aminés essentiels (EAA) et sont signalés pour augmenter la MPS après l’exercice. Louars et coll. ont montrés que la perfusion intraveineuse de BCAA pendant 3h augmente les concentrations plasmatiques de BCAA et diminue les concentrations des autres EAA. Ils ont également montré que la synthèse de protéines musculaire (MPS) et la dégradation des protéines musculaires (MPB : Muscle Protein Breakdown) étaient diminués de manière concomitante avec une concentration plasmatique « superphysiologique » de BCAA. Cela suggère que même avec des concentrations importantes de BCAA dans le plasma il n’y a pas d’augmentation du taux de MPS, mais aussi que la récupération augmente en diminuant la MPB. Cependant avec des doses raisonnables (5,6g 5 min après l’exercice), il y a une augmentation de la MPS de 22% par rapport à un placebo, mais que la réponse est tout de même 50% moins importante qu’avec du lactoserum (whey). Cela suggère que les BCAA sont incapable d’activer au maximum la MPS en raison de la disponibilité insuffisante des EAA, ils ne sont donc pas les suppléments optimaux pour augmenter la MPS. L’ingestion d’une protéine complète, enrichi en leucine est probablement plus efficace que tout mélange d’acide aminé spécifique.
La leucine joue un rôle important dans l’augmentation de la MPS après l’exercice, beaucoup se sont donc demandé si les BCAA pouvaient réguler la taille et la force musculaire mieux que le protéines complètes. Les BCAA (leucine, isoleucine et valine) sont trois des 9 acides aminés essentiels (EAA) et sont signalés pour augmenter la MPS après l’exercice. Louars et coll. ont montrés que la perfusion intraveineuse de BCAA pendant 3h augmente les concentrations plasmatiques de BCAA et diminue les concentrations des autres EAA. Ils ont également montré que la synthèse de protéines musculaire (MPS) et la dégradation des protéines musculaires (MPB : Muscle Protein Breakdown) étaient diminués de manière concomitante avec une concentration plasmatique « superphysiologique » de BCAA. Cela suggère que même avec des concentrations importantes de BCAA dans le plasma il n’y a pas d’augmentation du taux de MPS, mais aussi que la récupération augmente en diminuant la MPB. Cependant avec des doses raisonnables (5,6g 5 min après l’exercice), il y a une augmentation de la MPS de 22% par rapport à un placebo, mais que la réponse est tout de même 50% moins importante qu’avec du lactoserum (whey). Cela suggère que les BCAA sont incapable d’activer au maximum la MPS en raison de la disponibilité insuffisante des EAA, ils ne sont donc pas les suppléments optimaux pour augmenter la MPS. L’ingestion d’une protéine complète, enrichi en leucine est probablement plus efficace que tout mélange d’acide aminé spécifique.
Créatine :
La créatine est le supplément alimentaire le plus populaire pour améliorer la performance de force. La créatine maintient les niveaux d’ATP au cours de l’exercice, l’ATP étant nécessaire au muscle pour se contracter. Deux méta-analyses ont été publiées sur la supplémentation en créatine, elles ont montré une amélioration de la force au squat, et au développé couché avec un effet plus important chez le débutant que chez l’athlète entrainé. L’effet est encore plus important chez les végétariens, qui ont des taux de créatines plus bas sans supplémentation. Candow et coll. ont montré que l’effet de la créatine était plus important chez les hommes (+67%) que chez les femmes (+34%) pour l’augmentation de la force à la presse à cuisse. Une autre étude a montré un effet plus grand pour le gain de masse musculaire chez l’homme par rapport à la femme. Cela pourrait être du a des taux plus élevés des processus anti-catabolique chez les hommes. Olsen et coll. ont montré une augmentation de la formation des cellules satellites dans le muscle humain chez les personnes prenant une supplémentation en créatine associé à un entrainement de la force. Les auteurs suggèrent que la supplémentation peut être mises en place dans certains cas chez l’enfant et l’adolescent s’il est encadré par du personnel médical et nutritionnel. Les doses recommandées ne semblent pas nuire à la santé des athlètes en bonne santé, et pouvoir améliorer leurs performances.
La créatine est le supplément alimentaire le plus populaire pour améliorer la performance de force. La créatine maintient les niveaux d’ATP au cours de l’exercice, l’ATP étant nécessaire au muscle pour se contracter. Deux méta-analyses ont été publiées sur la supplémentation en créatine, elles ont montré une amélioration de la force au squat, et au développé couché avec un effet plus important chez le débutant que chez l’athlète entrainé. L’effet est encore plus important chez les végétariens, qui ont des taux de créatines plus bas sans supplémentation. Candow et coll. ont montré que l’effet de la créatine était plus important chez les hommes (+67%) que chez les femmes (+34%) pour l’augmentation de la force à la presse à cuisse. Une autre étude a montré un effet plus grand pour le gain de masse musculaire chez l’homme par rapport à la femme. Cela pourrait être du a des taux plus élevés des processus anti-catabolique chez les hommes. Olsen et coll. ont montré une augmentation de la formation des cellules satellites dans le muscle humain chez les personnes prenant une supplémentation en créatine associé à un entrainement de la force. Les auteurs suggèrent que la supplémentation peut être mises en place dans certains cas chez l’enfant et l’adolescent s’il est encadré par du personnel médical et nutritionnel. Les doses recommandées ne semblent pas nuire à la santé des athlètes en bonne santé, et pouvoir améliorer leurs performances.
Un exercice de force implique un exercice intense pendant une courte durée. Les contractions musculaires sont alors alimentées par l’ATP, et le mécanisme aérobie est trop lent pour répondre à la demande. La glycolyse donne du pyruvate qui dans ces conditions va être métabolisé en lactate conduisant à la production d’ions H+. Ces ions H+ inhibe la glycolyse en atténuant le taux de resynthèse de l’ATP, mais affectent aussi la fonction contractile. Pour atténuer les effets de l’augmentation des ions H+, le muscle squelettique possède la carnosine, un agent tampon qui atténue l’acidose musculaire et retarde donc l’apparition de la fatigue. On trouve des taux élevés de carnosine dans les muscles squelettiques en particulier des fibres II. La carnosine est synthétisé dans le muscle par liaison de la β-alanine à l’histidine. La production de carnosine est limitée dans l’organisme par le disponibilité de la β-alanine. On trouve la β-alanine dans la viande et le poisson, les végétariens peuvent avoir jusqu’à 26% de carnosine en moins. Il n’y a pas de preuve qu’aujourd’hui l’entrainement augmente le taux de carnosine musculaire, mais il peut modifier le type de fibre ce qui expliquerait que les sprinters ont des niveaux de carnosine plus important que les marathoniens. La supplémentation en β-alanine et aujourd’hui recommandé par la Société internationale de nutrition sportive. L’ingestion de 4 à 6g par jour de β-alanine pendant 4 semaines augmente de 40 à 60% le niveau de carnosine musculaire. Cependant des grands bolus de β-alanine peuvent produire des paresthésies et avoir des effets néfastes sur la performance. Il faut donc les consommer en petites doses ou dans des capsules à diffusion prolongée. Dans une méta-analyse Hosbon et coll. ont montré que la supplémentation en β-alanine est efficace pour un effort allant de 1 à 4 minutes. Des études ont montré une amélioration sur l’endurance isométrique après 4 semaines de supplémentation (Vente et coll.) mais aussi sur le nombre de répétitions de squat à 70% de 1RM, ou encore sur la performance de sauts répétés ou de sauts explosifs. D’autres études ont eu des effets plus mitigés sur la force isocinétique ou sur l’endurance. Il semblerait qu’elle retarde la fatigue, et qu’elle soit efficace chez les athlètes entrainés ou non, chez les hommes et chez les femmes dans le cadre d’efforts anaérobies.
Ω3 Acides gras polyinsaturé (PUFAs) :
Les oméga 3 PUFAs sont un sous ensemble d’acides gras. Ce sont des acides gras essentiels. Ils ont présents dans les poissons gras et l’huile le lin notamment. Les plus bioactifs des oméga 3 sont l’acide éicosapentaénoïque (EPA) et l’acide docoshexaénoïque (DHA). Ils sont censés favoriser le remodelage musculaire et la réparation musculaire par une MPS augmentée. La supplémentation en oméga 3 PUFAs améliore les mesures fonctionnelles telles que se relever d’une chaise ou un test de 6 minutes de marche. Cependant ces effets ont été observés chez les femmes mais pas chez les hommes. Les hommes ont cependant recensé moins de douleurs musculaires par rapport à un placebo. Il se pourrait que les oméga 3 diminuent les dégradations musculaires induites par la contraction et améliorent l’adaptation.
Les oméga 3 PUFAs sont un sous ensemble d’acides gras. Ce sont des acides gras essentiels. Ils ont présents dans les poissons gras et l’huile le lin notamment. Les plus bioactifs des oméga 3 sont l’acide éicosapentaénoïque (EPA) et l’acide docoshexaénoïque (DHA). Ils sont censés favoriser le remodelage musculaire et la réparation musculaire par une MPS augmentée. La supplémentation en oméga 3 PUFAs améliore les mesures fonctionnelles telles que se relever d’une chaise ou un test de 6 minutes de marche. Cependant ces effets ont été observés chez les femmes mais pas chez les hommes. Les hommes ont cependant recensé moins de douleurs musculaires par rapport à un placebo. Il se pourrait que les oméga 3 diminuent les dégradations musculaires induites par la contraction et améliorent l’adaptation.
Conclusion :
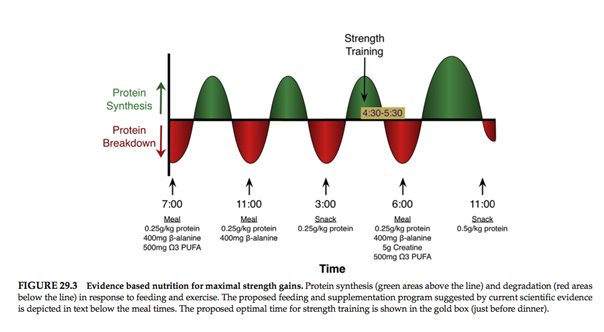
En se basant sur les recherchent présentés précédemment, les auteurs suggèrent la stratégie nutritionnelle suivante pour améliorer la force, et les gains de masse musculaire au cours d’une période de renforcement musculaire.
1. Consommer 0,25g/kg de poids corporel de protéines enrichies en leucine rapidement absorbable peu après l’entrainement et environ 4h après.
2. Prendre 5g de monohydrate de créatine avec le diner chaque soir.
3. Prendre 5g de β-alanine pendant 2 semaines puis une dose d’entretien de 1,2g de β-alanine par jour. Prendre 3 fois 400mg par repas pour éviter les paresthésies.
4. Prendre 500 mg d’oméga 3 le matin et après l’exercice.
Même si ces interventions nutritionnelles ont été faites à partir de la littérature scientifique, d'autres recherches sont nécessaires pour comprendre comment ces interventions nutritionnelles interagissent et s'il y a des effets négatifs de la supplémentation prolongée sur la santé
En se basant sur les recherchent présentés précédemment, les auteurs suggèrent la stratégie nutritionnelle suivante pour améliorer la force, et les gains de masse musculaire au cours d’une période de renforcement musculaire.
1. Consommer 0,25g/kg de poids corporel de protéines enrichies en leucine rapidement absorbable peu après l’entrainement et environ 4h après.
2. Prendre 5g de monohydrate de créatine avec le diner chaque soir.
3. Prendre 5g de β-alanine pendant 2 semaines puis une dose d’entretien de 1,2g de β-alanine par jour. Prendre 3 fois 400mg par repas pour éviter les paresthésies.
4. Prendre 500 mg d’oméga 3 le matin et après l’exercice.
Même si ces interventions nutritionnelles ont été faites à partir de la littérature scientifique, d'autres recherches sont nécessaires pour comprendre comment ces interventions nutritionnelles interagissent et s'il y a des effets négatifs de la supplémentation prolongée sur la santé
Article original:
Article issu du livre Nutrition and Enhanced Sports Performance, Second Edition
DOI : http://doi.org/10.1016/B978-0-12-813922-6.00029-1
Article issu du livre Nutrition and Enhanced Sports Performance, Second Edition
DOI : http://doi.org/10.1016/B978-0-12-813922-6.00029-1
Références:
[1] WHO. Health and ageing: a discussion paper. 2001. p. 1–40.
[2] Ruiz JR, Sui X, Lobelo F, Morrow Jr JR, Jackson AW, Sjostrom M, Blair SN. Association between muscular strength and mortality in men : prospective cohort study. BMJ 2008;337:a439.
[3] Srikanthan P, Karlamangla AS. Muscle mass index as a predictor of longevity in older adults. Am J Med 2014;127:547–53.
[4] Rantanen T, Masaki K, He Q, Ross GW, Willcox BJ, White L. Midlife muscle strength and human longevity up to age 100 years: a 44-year prospective study among a decedent cohort. Age (Dordr) 2012;34:563–70.
[5] Baar K. The signaling underlying FITness. Appl Physiol Nutr Metab 2009;34:411–9.
[6] Folland JP, Williams AG. The adaptations to strength training: morphological and neurological contributions to increased strength. Sports Med 2007;37:145–68.
[7] Mendias CL, Marcin JE, Calerdon DR, Faulkner JA. Contractile properties of EDL and soleus muscles of myostatin-deficient mice. J Appl Physiol 2006;101:898–905.
[8] Miller BF, Olesen JL, Hansen M, Dossing S, Crameri RM, Welling RJ, Langberg H, Flyvbjerg A, Kjaer M, Babraj JA, Smith K, Rennie MJ. Coordinated collagen and muscle protein synthesis in human patella tendon and quadriceps muscle after exercise. J Physiol 2005;567:1021–33.
[9] Cermak NM, Res PT, de Groot LC, Saris WH, van Loon LJ. Protein supplementation augments the adaptive response of skeletal muscle to resistance-type exercise training: a meta-analysis. Am J Clin Nutr 2012;96:1454–64.
[10] Tipton KD, Ferrando AA, Phillips SM, Doyle Jr D, Wolfe RR. Postexercise net protein synthesis in human muscle from orally administered amino acids. Am J Physiol 1999;276:E628–34.
[11] Pennings B, Groen BB, van Dijk JW, de Lange A, Kiskini A, Kuklinski M, Senden JM, van Loon LJ. Minced beef is more rapidly digested and absorbed than beef steak, resulting in greater postprandial protein retention in older men. Am J Clin Nutr 2013;98:121–8.
[12] Moberg M, Apro W, Ohlsson I, Ponten M, Villanueva A, Ekblom B, Blomstrand E. Absence of leucine in an essential amino acid supplement reduces activation of mTORC1 signalling following resistance exercise in young females. Appl Physiol Nutr Metab 2014;39:183–94.
[13] Churchward-Venne TA, Burd NA, Mitchell CJ, West DW, Philp A, Marcotte GR, Baker SK, Baar K, Phillips SM. Supplementation of a sub- optimal protein dose with leucine or essential amino acids: effects on myofibrillar protein synthesis at rest and following resistance exercise in men. J Physiol 2012;590:2751–65.
[14] Moore DR, Robinson MJ, Fry JL, Tang JE, Glover EI, Wilkinson SB, Prior T, Tarnopolsky MA, Phillips SM. Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men. Am J Clin Nutr 2009;89:161–8.
[15] Robinson MJ, Burd NA, Breen L, Rerecich T, Yang Y, Hector AJ, Baker SK, Phillips SM. Dose-dependent responses of myofibrillar protein synthesis with beef ingestion are enhanced with resistance exercise in middle-aged men. Appl Physiol Nutr Metab 2013;38:120–5.
[16] Areta JL, Burke LM, Camera DM, West DW, Crawshay S, Moore DR, Stellingwerff T, Phillips SM, Hawley JA, Coffey VG. Reduced resting skeletal muscle protein synthesis is rescued by resistance exercise and protein ingestion following short-term energy deficit. Am J Physiol Endocrinol Metab 2014;306:E989–97.
[17]MacnaughtonLS,WardleSL,WitardOC,McGloryC,HamiltonDL,JeromsonS,LawrenceCE,WallisGA,TiptonKD.Theresponseofmuscle protein synthesis following whole-body resistance exercise is greater following 40 g than 20 g of ingested whey protein. Physiol Rep 2016;4.
[18] Menon S, Dibble CC, Talbott G, Hoxhaj G, Valvezan AJ, Takahashi H, Cantley LC, Manning BD. Spatial control of the TSC complex inte-grates insulin and nutrient regulation of mTORC1 at the lysosome. Cell 2014;156:771–85.
[19] Wolfson RL, Chantranupong L, Saxton RA, Shen K, Scaria SM, Cantor JR, Sabatini DM. Sestrin2 is a leucine sensor for the mTORC1 pathway. Science 2016;351:43–8.
[20] Bar-Peled L, Chantranupong L, Cherniack AD, Chen WW, Ottina KA, Grabiner BC, Spear ED, Carter SL, Meyerson M, Sabatini DM. A Tumor suppressor complex with GAP activity for the Rag GTPases that signal amino acid sufficiency to mTORC1. Science 2013;340:1100–6.
[21] Bar-Peled L, Schweitzer LD, Zoncu R, Sabatini DM. Regulator is a GEF for the rag GTPases that signal amino acid levels to mTORC1. Cell 2012;150:1196–208.
[22] Drummond MJ, Dreyer HC, Fry CS, Glynn EL, Rasmussen BB. Nutritional and contractile regulation of human skeletal muscle protein synthesis and mTORC1 signaling. J Appl Physiol (1985) 2009;106:1374–84.
[23] Drummond MJ, Fry CS, Glynn EL, Dreyer HC, Dhanani S, Timmerman KL, Volpi E, Rasmussen BB. Rapamycin administration in humans blocks the contraction-induced increase in skeletal muscle protein synthesis. J Physiol 2009;587:1535–46.
[24] Dickinson JM, Fry CS, Drummond MJ, Gundermann DM, Walker DK, Glynn EL, Timmerman KL, Dhanani S, Volpi E, Rasmussen BB. Mammalian target of rapamycin complex 1 activation is required for the stimulation of human skeletal muscle protein synthesis by essential amino acids. J Nutr 2011;141:856–62.
[25] Jackson MJ. Control of reactive oxygen species production in contracting skeletal muscle. Antioxidants Redox Signal 2011;15:2477–86.
[26] MacKenzie MG, Hamilton DL, Murray JT, Taylor PM, Baar K. mVps34 is activated following high-resistance contractions. J Physiol 2009;587:253–60.
[27] West DW, Baehr LM, Marcotte GR, Chason CM, Tolento L, Gomes AV, Bodine SC, Baar K. Acute resistance exercise activates rapamycin-sensitive and -insensitive mechanisms that control translational activity and capacity in skeletal muscle. J Physiol 2016;594:453–68.
[28] Hamilton DL, Philp A, MacKenzie MG, Baar K. A limited role for PI(3,4,5)P3 regulation in controlling skeletal muscle mass in response to resistance exercise. PLoS One 2010;5:e11624.
[29] Burd NA, West DW, Moore DR, Atherton PJ, Staples AW, Prior T, Tang JE, Rennie MJ, Baker SK, Phillips SM. Enhanced amino acid sensitivity of myofibrillar protein synthesis persists for up to 24 h after resistance exercise in young men. J Nutr 2011;141:568–73.
[30] Blomstrand E, Eliasson J, Karlsson HK, Kohnke R. Branched-chain amino acids activate key enzymes in protein synthesis after physical exercise. J Nutr 2006;136:269S–73S.
[31] Jackman SR, Witard OC, Philp A, Wallis GA, Baar K, Tipton KD. Branched-chain amino acid ingestion stimulates muscle myofibrillar protein synthesis following resistance exercise in humans. Front Physiol 2017;8:390.
[32] Louard RJ, Barrett EJ, Gelfand RA. Overnight branched-chain amino acid infusion causes sustained suppression of muscle proteolysis. Metabolism 1995;44:424–9.
[33] Louard RJ, Barrett EJ, Gelfand RA. Effect of infused branched-chain amino acids on muscle and whole-body amino acid metabolism in man. Clin Sci (Lond) 1990;79:457–66.
[34] Waldron M, Whelan K, Jeffries O, Burt D, Howe L, Patterson SD. The effects of acute branched-chain amino acid supplementation on recovery from a single bout of hypertrophy exercise in resistance-trained athletes. Appl Physiol Nutr Metab 2017;42:630–6.
[35] Fryburg DA, Barrett EJ, Louard RJ, Gelfand RA. Effect of starvation on human muscle protein metabolism and its response to insulin. Am J Physiol 1990;259:E477–82.
[36] Lowery RP, Joy JM, Rathmacher JA, Baier SM, Fuller Jr JC, Shelley 2nd MC, Jager R, Purpura M, Wilson SM, Wilson JM. Interaction of beta-hydroxy-beta-methylbutyrate free acid and adenosine triphosphate on muscle mass, strength, and power in resistance trained individuals. J Strength Cond Res 2016;30:1843–54.
[37] Wilson JM, Lowery RP, Joy JM, Andersen JC, Wilson SM, Stout JR, Duncan N, Fuller JC, Baier SM, Naimo MA, Rathmacher J. The effects of 12 weeks of beta-hydroxy-beta-methylbutyrate free acid supplementation on muscle mass, strength, and power in resistance-trained individuals: a randomized, double-blind, placebo-controlled study. Eur J Appl Physiol 2014;114:1217–27.
[38] Davidsen PK, Gallagher IJ, Hartman JW, Tarnopolsky MA, Dela F, Helge JW, Timmons JA, Phillips SM. High responders to resistance exercise training demonstrate differential regulation of skeletal muscle microRNA expression. J Appl Physiol (1985) 2011;110:309–17.
[39] Kim JS, Petrella JK, Cross JM, Bamman MM. Load-mediated downregulation of myostatin mRNA is not sufficient to promote myofiber hypertrophy in humans: a cluster analysis. J Appl Physiol (1985) 2007;103:1488–95.
[40] Stec MJ, Kelly NA, Many GM, Windham ST, Tuggle SC, Bamman MM. Ribosome biogenesis may augment resistance training-induced myofiber hypertrophy and is required for myotube growth in vitro. Am J Physiol Endocrinol Metab 2016;310(8):E652–E661. ajpendo 0048602015.
[41] Gentles JA, Phillips SM. Discrepancies in publications related to HMB-FA and ATP supplementation. Nutr Metab (Lond) 2017;14:42.
[42] Phillips SM, Aragon AA, Arciero PJ, Arent SM, Close GL, Hamilton DL, Helms ER, Henselmans M, Loenneke JP, Norton LE, Ormsbee MJ, Sale C, Schoenfeld BJ, SmithRyan AE, Tipton KD, Vukovich MD, Wilborn C, Willoughby DS. Changes in body composition and performance with supplemental HMB-FA+ATP. Strength Cond Res 2017;31(5):e71–e72.
[43] Thomson JS, Watson PE, Rowlands DS. Effects of nine weeks of beta-hydroxy-beta- methylbutyrate supplementation on strength and body composition in resistance trained men. J Strength Cond Res 2009;23:827–35.
[44] Wilkinson DJ, Hossain T, Limb MC, Phillips BE, Lund J, Williams JP, Brook MS, Cegielski J, Philp A, Ashcroft S, Rathmacher JA, Szewczyk NJ, Smith K, Atherton PJ. Impact of the calcium form of beta-hydroxy-beta-methylbutyrate upon human skeletal muscle protein metabo-lism. Clin Nutr 2017, https://doi.org/10.1016/j.clnu.2017.09.024.
[45] Kao M, Columbus DA, Suryawan A, Steinhoff-Wagner J, Hernandez-Garcia A, Nguyen HV, Fiorotto ML, Davis TA. Enteral beta-hydroxy-beta-methylbutyrate supplementation increases protein synthesis in skeletal muscle of neonatal pigs. Am J Physiol Endocrinol Metab 2016;310:E1072–84.
[46] Deutz NE, Pereira SL, Hays NP, Oliver JS, Edens NK, Evans CM, Wolfe RR. Effect of beta-hydroxy-beta-methylbutyrate (HMB) on lean body mass during 10 days of bed rest in older adults. Clin Nutr 2013;32:704–12.
[47] English KL, Mettler JA, Ellison JB, Mamerow MM, Arentson-Lantz E, Pattarini JM, Ploutz-Snyder R, Sheffield-Moore M, Paddon-Jones D. Leucine partially protects muscle mass and function during bed rest in middle-aged adults. Am J Clin Nutr 2016;103:465–73.
[48] Tscholl P, Alonso JM, Dolle G, Junge A, Dvorak J. The use of drugs and nutritional supplements in top-level track and field athletes. Am J Sports Med 2010;38:133–40.
[49] Williams MH, Branch JD. Creatine supplementation and exercise performance: an update. J Am Coll Nutr 1998;17:216–34.
[50] Lanhers C, Pereira B, Naughton G, Trousselard M, Lesage FX, Dutheil F. Creatine supplementation and upper limb strength performance: a systematic review and meta-analysis. Sports Med 2017;47:163–73.
[51] Burke DG, Chilibeck PD, Parise G, Candow DG, Mahoney D, Tarnopolsky M. Effect of creatine and weight training on muscle creatine and performance in vegetarians. Med Sci Sports Exerc 2003;35:1946–55.
[52] Kreider RB, Kalman DS, Antonio J, Ziegenfuss TN, Wildman R, Collins R, Candow DG, Kleiner SM, Almada AL, Lopez HL. International society of sports nutrition position stand: safety and efficacy of creatine supplementation in exercise, sport, and medicine. J Int Soc Sport Nutr 2017;14:18.
[53] Hultman E, Soderlund K, Timmons JA, Cederblad G, Greenhaff PL. Muscle creatine loading in men. J Appl Physiol (1985) 1996;81:232–7.
[54] Lanhers C, Pereira B, Naughton G, Trousselard M, Lesage FX, Dutheil F. Creatine supplementation and lower limb strength performance: a systematic review and meta-analyses. Sports Med 2015;45:1285–94.
[55] Rawson ES, Volek JS. Effects of creatine supplementation and resistance training on muscle strength and weightlifting performance. J Strength Cond Res 2003;17:822–31.
[56] Harris RC, Soderlund K, Hultman E. Elevation of creatine in resting and exercised muscle of normal subjects by creatine supplementation. Clin Sci (Lond) 1992;83:367–74.
[57] Candow DG, Chilibeck PD, Burke DG, Mueller KD, Lewis JD. Effect of different frequencies of creatine supplementation on muscle size and strength in young adults. J Strength Cond Res 2011;25:1831–8.
[58] Mihic S, MacDonald JR, McKenzie S, Tarnopolsky MA. Acute creatine loading increases fat-free mass, but does not affect blood pressure, plasma creatinine, or CK activity in men and women. Med Sci Sports Exerc 2000;32:291–6.
[59] Parise G, Mihic S, MacLennan D, Yarasheski KE, Tarnopolsky MA. Effects of acute creatine monohydrate supplementation on leucine kinet- ics and mixed-muscle protein synthesis. J Appl Physiol (1985) 2001;91:1041–7.
[60] Farshidfar F, Pinder MA, Myrie SB. Creatine supplementation and skeletal muscle metabolism for building muscle mass - review of the potential mechanisms of action. Curr Protein Pept Sci 2017;18:1273–87.
[61] Deldicque L, Louis M, Theisen D, Nielens H, Dehoux M, Thissen JP, Rennie MJ, Francaux M. Increased IGF mRNA in human skeletal muscle after creatine supplementation. Med Sci Sports Exerc 2005;37:731–6.
[62] Ham DJ, Caldow MK, Lynch GS, Koopman R. Arginine protects muscle cells from wasting in vitro in an mTORC1-dependent and NO-independent manner. Amino Acids 2014;46:2643–52.
[63] Deldicque L, Theisen D, Bertrand L, Hespel P, Hue L, Francaux M. Creatine enhances differentiation of myogenic C2C12 cells by activating both p38 and Akt/PKB pathways. Am J Physiol Cell Physiol 2007;293:C1263–71.
[64] Olsen S, Aagaard P, Kadi F, Tufekovic G, Verney J, Olesen JL, Suetta C, Kjaer M. Creatine supplementation augments the increase in satellite cell and myonuclei number in human skeletal muscle induced by strength training. J Physiol 2006;573:525–34.
[65] Petrella JK, Kim JS, Mayhew DL, Cross JM, Bamman MM. Potent myofiber hypertrophy during resistance training in humans is associated with satellite cell-mediated myonuclear addition: a cluster analysis. J Appl Physiol (1985) 2008;104:1736–42.
[66] Cornish SM, Chilibeck PD, Burke DG. The effect of creatine monohydrate supplementation on sprint skating in ice-hockey players. J Sports Med Phys Fit 2006;46:90–8.
[67] Dawson B, Vladich T, Blanksby BA. Effects of 4 weeks of creatine supplementation in junior swimmers on freestyle sprint and swim bench performance. J Strength Cond Res 2002;16:485–90.
[68] Juhasz I, Gyore I, Csende Z, Racz L, Tihanyi J. Creatine supplementation improves the anaerobic performance of elite junior fin swimmers. Acta Physiol Hung 2009;96:325–36.
[69] Poortmans JR, Francaux M. Adverse effects of creatine supplementation: fact or fiction? Sports Med 2000;30:155–70.
[70] Kutz MR, Gunter MJ. Creatine monohydrate supplementation on body weight and percent body fat. J Strength Cond Res 2003;17: 817–21.
[71] Dalbo VJ, Roberts MD, Stout JR, Kerksick CM. Putting to rest the myth of creatine supplementation leading to muscle cramps and dehydration. Br J Sports Med 2008;42:567–73.
[72] Baguet A, Koppo K, Pottier A, Derave W. Beta-alanine supplementation reduces acidosis but not oxygen uptake response during high-intensity cycling exercise. Eur J Appl Physiol 2010;108:495–503.
[73] Junge W, McLaughlin S. The role of fixed and mobile buffers in the kinetics of proton movement. Biochim Biophys Acta 1987;890:1–5.
[74] Boldyrev AA, Aldini G, Derave W. Physiology and pathophysiology of carnosine. Physiol Rev 2013;93:1803–45.
[75] Tanokura MTM, Miyazawa T. 1H nuclear magnetic resonance studies of histidine-containing di- and tripeptides. Estimation of the effects of charged groups on the pKa value of the imidazole ring. Biopolymers 1976;15:393–401.
[76] Harris RC, Wise JA, Price KA, Kim HJ, Kim CK, Sale C. Determinants of muscle carnosine content. Amino Acids 2012;43:5–12.
[77] Stellingwerff T, Anwander H, Egger A, Buehler T, Kreis R, Decombaz J, Boesch C. Effect of two beta-alanine dosing protocols on muscle carnosine synthesis and washout. Amino Acids 2012;42:2461–72.
[78] Mannion AF, Jakeman PM, Dunnett M, Harris RC, Willan PL. Carnosine and anserine concentrations in the quadriceps femoris muscle of healthy humans. Eur J Appl Physiol Occup Physiol 1992;64:47–50.
[79] del Favero S, Roschel H, Solis MY, Hayashi AP, Artioli GG, Otaduy MC, Benatti FB, Harris RC, Wise JA, Leite CC, Pereira RM, de Sa-Pinto AL, Lancha-Junior AH, Gualano B. Beta-alanine (Carnosyn) supplementation in elderly subjects (60-80 years): effects on muscle carnosine content and physical capacity. Amino Acids 2012;43:49–56.
[80] Harris RCJG, Hill CH, Kendrick IP, Boobis L, Kim CK, Kim HJ, Dang VH, Edge J, Wise JA. The carnosine content of V Lateralis in vegetarians and omnivores. FASEB J 2007;21.
[81] Tallon MJ, Harris RC, Maffulli N, Tarnopolsky MA. Carnosine, taurine and enzyme activities of human skeletal muscle fibres from elderly subjects with osteoarthritis and young moderately active subjects. Biogerontology 2007;8:129–37.
[82] Dutka TL, Lamboley CR, McKenna MJ, Murphy RM, Lamb GD. Effects of carnosine on contractile apparatus Ca(2)(+) sensitivity and sarcoplasmic reticulum Ca(2)(+) release in human skeletal muscle fibers. J Appl Physiol (1985) 2012;112:728–36.
[83] Harris RC, Tallon MJ, Dunnett M, Boobis L, Coakley J, Kim HJ, Fallowfield JL, Hill CA, Sale C, Wise JA. The absorption of orally supplied beta-alanine and its effect on muscle carnosine synthesis in human vastus lateralis. Amino Acids 2006;30:279–89.
[84] Everaert I, Mooyaart A, Baguet A, Zutinic A, Baelde H, Achten E, Taes Y, De Heer E, Derave W. Vegetarianism, female gender and increasing age, but not CNDP1 genotype, are associated with reduced muscle carnosine levels in humans. Amino Acids 2011;40:1221–9.
[85] Schiaffino S, Reggiani C. Fiber types in mammalian skeletal muscles. Physiol Rev 2011;91:1447–531.
[86] Parkhouse WS, McKenzie DC, Hochachka PW, Ovalle WK. Buffering capacity of deproteinized human vastus lateralis muscle. J Appl Physiol (1985) 1985;58:14–7.
[87] Trexler ET, Smith-Ryan AE, Stout JR, Hoffman JR, Wilborn CD, Sale C, Kreider RB, Jager R, Earnest CP, Bannock L, Campbell B, Kalman D, Ziegenfuss TN, Antonio J. International society of sports nutrition position stand: beta-alanine. J Int Soc Sports Nutr 2015;12:30.
[88] Decombaz J, Beaumont M, Vuichoud J, Bouisset F, Stellingwerff T. Effect of slow-release beta-alanine tablets on absorption kinetics and paresthesia. Amino Acids 2012;43:67–76.
[89] Stegen S, Blancquaert L, Everaert I, Bex T, Taes Y, Calders P, Achten E, Derave W. Meal and beta-alanine coingestion enhances muscle carnosine loading. Med Sci Sports Exerc 2013;45:1478–85.
[90] Stegen S, Bex T, Vervaet C, Vanhee L, Achten E, Derave W. Beta-alanine dose for maintaining moderately elevated muscle carnosine levels. Med Sci Sports Exerc 2014;46:1426–32.
[91] Baguet A, Reyngoudt H, Pottier A, Everaert I, Callens S, Achten E, Derave W. Carnosine loading and washout in human skeletal muscles. J Appl Physiol (1985) 2009;106:837–42.
[92] Hobson RM, Saunders B, Ball G, Harris RC, Sale C. Effects of beta-alanine supplementation on exercise performance: a meta-analysis. Amino Acids 2012;43:25–37.
[93] Sale C, Hill CA, Ponte J, Harris RC. Beta-alanine supplementation improves isometric endurance of the knee extensor muscles. J Int Soc Sports Nutr 2012;9:26.
[94] Hoffman JR, Ratamess NA, Faigenbaum AD, Ross R, Kang J, Stout JR, Wise JA. Short-duration beta-alanine supplementation increases training volume and reduces subjective feelings of fatigue in college football players. Nutr Res 2008;28:31–5.
[95] Rosas F, Ramirez-Campillo R, Martinez C, Caniuqueo A, Canas-Jamet R, McCrudden E, Meylan C, Moran J, Nakamura FY, Pereira LA, Loturco I, Diaz D, Izquierdo M. Effects of plyometric training and beta-alanine supplementation on maximal-intensity exercise and endur- ance in female soccer players. J Hum Kinet 2017;58:99–109.
[96] Carpentier A, Olbrechts N, Vieillevoye S, Poortmans JR. Beta-alanine supplementation slightly enhances repeated plyometric performance after high-intensity training in humans. Amino Acids 2015;47:1479–83.
[97] Derave W, Ozdemir MS, Harris RC, Pottier A, Reyngoudt H, Koppo K, Wise JA, Achten E. beta-Alanine supplementation augments muscle carnosine content and attenuates fatigue during repeated isokinetic contraction bouts in trained sprinters. J Appl Physiol (1985) 2007;103:1736–43.
[98] Kendrick IP, Harris RC, Kim HJ, Kim CK, Dang VH, Lam TQ, Bui TT, Smith M, Wise JA. The effects of 10 weeks of resistance training com- bined with beta-alanine supplementation on whole body strength, force production, muscular endurance and body composition. Amino Acids 2008;34:547–54.
[99] Kern BD, Robinson TL. Effects of beta-alanine supplementation on performance and body composition in collegiate wrestlers and football players. J Strength Cond Res 2011;25:1804–15.
[100] Glenn JM, Gray M, Stewart Jr RW, Moyen NE, Kavouras SA, DiBrezzo R, Turner R, Baum JI, Stone MS. Effects of 28-day beta-alanine supple- mentation on isokinetic exercise performance and body composition in female masters athletes. J Strength Cond Res 2016;30:200–7.
[101] Smith GI, Atherton P, Reeds DN, Mohammed BS, Rankin D, Rennie MJ, Mittendorfer B. Omega-3 polyunsaturated fatty acids augment the muscle protein anabolic response to hyperinsulinaemia-hyperaminoacidaemia in healthy young and middle-aged men and women. Clin Sci (Lond) 2011;121:267–78.
[102] Smith GI, Atherton P, Reeds DN, Mohammed BS, Rankin D, Rennie MJ, Mittendorfer B. Dietary omega-3 fatty acid supplementation increases the rate of muscle protein synthesis in older adults: a randomized controlled trial. Am J Clin Nutr 2011;93:402–12.
[103] Kamolrat T, Gray SR. The effect of eicosapentaenoic and docosahexaenoic acid on protein synthesis and breakdown in murine C2C12 myo- tubes. Biochem Biophys Res Commun 2013;432:593–8.
[104] Song Z, Moore DR, Hodson N, Ward C, Dent JR, O’Leary MF, Shaw AM, Hamilton DL, Sarkar S, Gangloff YG, Hornberger TA, Spriet LL, Heigenhauser GJ, Philp A. Resistance exercise initiates mechanistic target of rapamycin (mTOR) translocation and protein complex co- localisation in human skeletal muscle. Sci Rep 2017;7:5028.
[105] McGlory C, Wardle SL, Macnaughton LS, Witard OC, Scott F, Dick J, Bell JG, Phillips SM, Galloway SD, Hamilton DL, Tipton KD. Fish oil supplementation suppresses resistance exercise and feeding-induced increases in anabolic signaling without affecting myofibrillar protein synthesis in young men. Physiol Rep 2016;4.
[106] Da Boit M, Sibson R, Sivasubramaniam S, Meakin JR, Greig CA, Aspden RM, Thies F, Jeromson S, Hamilton DL, Speakman JR, Hambly C, Mangoni AA, Preston T, Gray SR. Sex differences in the effect of fish-oil supplementation on the adaptive response to resistance exercise training in older people: a randomized controlled trial. Am J Clin Nutr 2017;105:151–8.
[107] Rodacki CL, Rodacki AL, Pereira G, Naliwaiko K, Coelho I, Pequito D, Fernandes LC. Fish-oil supplementation enhances the effects of strength training in elderly women. Am J Clin Nutr 2012;95:428–36.
[108] Tsuchiya Y, Yanagimoto K, Nakazato K, Hayamizu K, Ochi E. Eicosapentaenoic and docosahexaenoic acids-rich fish oil supplementation attenuates strength loss and limited joint range of motion after eccentric contractions: a randomized, double-blind, placebo-controlled, parallel-group trial. Eur J Appl Physiol 2016;116:1179–88.
[109] Nissen S, Sharp R, Ray M, Rathmacher JA, Rice D, Fuller Jr JC, Connelly AS, Abumrad N. Effect of leucine metabolite beta-hydroxy-beta- methylbutyrate on muscle metabolism during resistance-exercise training. J Appl Physiol (1985) 1996;81(5):2095–104.
[110] Panton LB, Rathmacher JA, Baier S, Nissen S. Nutritional supplementation of the leucine metabolite beta-hydroxy-beta-methylbutyrate (hmb) during resistance training. Nutrition 2000;16(9):734–39.
[111] Jowko E, Ostaszewski P, Jank M, Sacharuk J, Zieniewicz A, Wilczak J, Nissen S. Creatine and beta-hydroxy-beta-methylbutyrate (HMB) additively increase lean body mass and muscle strength during a weight-training program. Nutrition 2001;17(7–8):558–66.
[112] Slater G, Jenkins D, Logan P, Lee H, Vukovich M, Rathmacher JA, Hahn AG. Beta-hydroxy-beta-methylbutyrate (HMB) supplementa- tion does not affect changes in strength or body composition during resistance training in trained men. Int J Sport Nutr Exerc Metab 2001;11(3):384–96.
[113] Kreider RB, Ferreira M, Wilson M, Almada AL. Effects of calcium beta-hydroxy-beta-methylbutyrate (HMB) supplementation during resistance-training on markers of catabolism, body composition and strength. Int J Sports Med 1999;20(8):503–9.
[1] WHO. Health and ageing: a discussion paper. 2001. p. 1–40.
[2] Ruiz JR, Sui X, Lobelo F, Morrow Jr JR, Jackson AW, Sjostrom M, Blair SN. Association between muscular strength and mortality in men : prospective cohort study. BMJ 2008;337:a439.
[3] Srikanthan P, Karlamangla AS. Muscle mass index as a predictor of longevity in older adults. Am J Med 2014;127:547–53.
[4] Rantanen T, Masaki K, He Q, Ross GW, Willcox BJ, White L. Midlife muscle strength and human longevity up to age 100 years: a 44-year prospective study among a decedent cohort. Age (Dordr) 2012;34:563–70.
[5] Baar K. The signaling underlying FITness. Appl Physiol Nutr Metab 2009;34:411–9.
[6] Folland JP, Williams AG. The adaptations to strength training: morphological and neurological contributions to increased strength. Sports Med 2007;37:145–68.
[7] Mendias CL, Marcin JE, Calerdon DR, Faulkner JA. Contractile properties of EDL and soleus muscles of myostatin-deficient mice. J Appl Physiol 2006;101:898–905.
[8] Miller BF, Olesen JL, Hansen M, Dossing S, Crameri RM, Welling RJ, Langberg H, Flyvbjerg A, Kjaer M, Babraj JA, Smith K, Rennie MJ. Coordinated collagen and muscle protein synthesis in human patella tendon and quadriceps muscle after exercise. J Physiol 2005;567:1021–33.
[9] Cermak NM, Res PT, de Groot LC, Saris WH, van Loon LJ. Protein supplementation augments the adaptive response of skeletal muscle to resistance-type exercise training: a meta-analysis. Am J Clin Nutr 2012;96:1454–64.
[10] Tipton KD, Ferrando AA, Phillips SM, Doyle Jr D, Wolfe RR. Postexercise net protein synthesis in human muscle from orally administered amino acids. Am J Physiol 1999;276:E628–34.
[11] Pennings B, Groen BB, van Dijk JW, de Lange A, Kiskini A, Kuklinski M, Senden JM, van Loon LJ. Minced beef is more rapidly digested and absorbed than beef steak, resulting in greater postprandial protein retention in older men. Am J Clin Nutr 2013;98:121–8.
[12] Moberg M, Apro W, Ohlsson I, Ponten M, Villanueva A, Ekblom B, Blomstrand E. Absence of leucine in an essential amino acid supplement reduces activation of mTORC1 signalling following resistance exercise in young females. Appl Physiol Nutr Metab 2014;39:183–94.
[13] Churchward-Venne TA, Burd NA, Mitchell CJ, West DW, Philp A, Marcotte GR, Baker SK, Baar K, Phillips SM. Supplementation of a sub- optimal protein dose with leucine or essential amino acids: effects on myofibrillar protein synthesis at rest and following resistance exercise in men. J Physiol 2012;590:2751–65.
[14] Moore DR, Robinson MJ, Fry JL, Tang JE, Glover EI, Wilkinson SB, Prior T, Tarnopolsky MA, Phillips SM. Ingested protein dose response of muscle and albumin protein synthesis after resistance exercise in young men. Am J Clin Nutr 2009;89:161–8.
[15] Robinson MJ, Burd NA, Breen L, Rerecich T, Yang Y, Hector AJ, Baker SK, Phillips SM. Dose-dependent responses of myofibrillar protein synthesis with beef ingestion are enhanced with resistance exercise in middle-aged men. Appl Physiol Nutr Metab 2013;38:120–5.
[16] Areta JL, Burke LM, Camera DM, West DW, Crawshay S, Moore DR, Stellingwerff T, Phillips SM, Hawley JA, Coffey VG. Reduced resting skeletal muscle protein synthesis is rescued by resistance exercise and protein ingestion following short-term energy deficit. Am J Physiol Endocrinol Metab 2014;306:E989–97.
[17]MacnaughtonLS,WardleSL,WitardOC,McGloryC,HamiltonDL,JeromsonS,LawrenceCE,WallisGA,TiptonKD.Theresponseofmuscle protein synthesis following whole-body resistance exercise is greater following 40 g than 20 g of ingested whey protein. Physiol Rep 2016;4.
[18] Menon S, Dibble CC, Talbott G, Hoxhaj G, Valvezan AJ, Takahashi H, Cantley LC, Manning BD. Spatial control of the TSC complex inte-grates insulin and nutrient regulation of mTORC1 at the lysosome. Cell 2014;156:771–85.
[19] Wolfson RL, Chantranupong L, Saxton RA, Shen K, Scaria SM, Cantor JR, Sabatini DM. Sestrin2 is a leucine sensor for the mTORC1 pathway. Science 2016;351:43–8.
[20] Bar-Peled L, Chantranupong L, Cherniack AD, Chen WW, Ottina KA, Grabiner BC, Spear ED, Carter SL, Meyerson M, Sabatini DM. A Tumor suppressor complex with GAP activity for the Rag GTPases that signal amino acid sufficiency to mTORC1. Science 2013;340:1100–6.
[21] Bar-Peled L, Schweitzer LD, Zoncu R, Sabatini DM. Regulator is a GEF for the rag GTPases that signal amino acid levels to mTORC1. Cell 2012;150:1196–208.
[22] Drummond MJ, Dreyer HC, Fry CS, Glynn EL, Rasmussen BB. Nutritional and contractile regulation of human skeletal muscle protein synthesis and mTORC1 signaling. J Appl Physiol (1985) 2009;106:1374–84.
[23] Drummond MJ, Fry CS, Glynn EL, Dreyer HC, Dhanani S, Timmerman KL, Volpi E, Rasmussen BB. Rapamycin administration in humans blocks the contraction-induced increase in skeletal muscle protein synthesis. J Physiol 2009;587:1535–46.
[24] Dickinson JM, Fry CS, Drummond MJ, Gundermann DM, Walker DK, Glynn EL, Timmerman KL, Dhanani S, Volpi E, Rasmussen BB. Mammalian target of rapamycin complex 1 activation is required for the stimulation of human skeletal muscle protein synthesis by essential amino acids. J Nutr 2011;141:856–62.
[25] Jackson MJ. Control of reactive oxygen species production in contracting skeletal muscle. Antioxidants Redox Signal 2011;15:2477–86.
[26] MacKenzie MG, Hamilton DL, Murray JT, Taylor PM, Baar K. mVps34 is activated following high-resistance contractions. J Physiol 2009;587:253–60.
[27] West DW, Baehr LM, Marcotte GR, Chason CM, Tolento L, Gomes AV, Bodine SC, Baar K. Acute resistance exercise activates rapamycin-sensitive and -insensitive mechanisms that control translational activity and capacity in skeletal muscle. J Physiol 2016;594:453–68.
[28] Hamilton DL, Philp A, MacKenzie MG, Baar K. A limited role for PI(3,4,5)P3 regulation in controlling skeletal muscle mass in response to resistance exercise. PLoS One 2010;5:e11624.
[29] Burd NA, West DW, Moore DR, Atherton PJ, Staples AW, Prior T, Tang JE, Rennie MJ, Baker SK, Phillips SM. Enhanced amino acid sensitivity of myofibrillar protein synthesis persists for up to 24 h after resistance exercise in young men. J Nutr 2011;141:568–73.
[30] Blomstrand E, Eliasson J, Karlsson HK, Kohnke R. Branched-chain amino acids activate key enzymes in protein synthesis after physical exercise. J Nutr 2006;136:269S–73S.
[31] Jackman SR, Witard OC, Philp A, Wallis GA, Baar K, Tipton KD. Branched-chain amino acid ingestion stimulates muscle myofibrillar protein synthesis following resistance exercise in humans. Front Physiol 2017;8:390.
[32] Louard RJ, Barrett EJ, Gelfand RA. Overnight branched-chain amino acid infusion causes sustained suppression of muscle proteolysis. Metabolism 1995;44:424–9.
[33] Louard RJ, Barrett EJ, Gelfand RA. Effect of infused branched-chain amino acids on muscle and whole-body amino acid metabolism in man. Clin Sci (Lond) 1990;79:457–66.
[34] Waldron M, Whelan K, Jeffries O, Burt D, Howe L, Patterson SD. The effects of acute branched-chain amino acid supplementation on recovery from a single bout of hypertrophy exercise in resistance-trained athletes. Appl Physiol Nutr Metab 2017;42:630–6.
[35] Fryburg DA, Barrett EJ, Louard RJ, Gelfand RA. Effect of starvation on human muscle protein metabolism and its response to insulin. Am J Physiol 1990;259:E477–82.
[36] Lowery RP, Joy JM, Rathmacher JA, Baier SM, Fuller Jr JC, Shelley 2nd MC, Jager R, Purpura M, Wilson SM, Wilson JM. Interaction of beta-hydroxy-beta-methylbutyrate free acid and adenosine triphosphate on muscle mass, strength, and power in resistance trained individuals. J Strength Cond Res 2016;30:1843–54.
[37] Wilson JM, Lowery RP, Joy JM, Andersen JC, Wilson SM, Stout JR, Duncan N, Fuller JC, Baier SM, Naimo MA, Rathmacher J. The effects of 12 weeks of beta-hydroxy-beta-methylbutyrate free acid supplementation on muscle mass, strength, and power in resistance-trained individuals: a randomized, double-blind, placebo-controlled study. Eur J Appl Physiol 2014;114:1217–27.
[38] Davidsen PK, Gallagher IJ, Hartman JW, Tarnopolsky MA, Dela F, Helge JW, Timmons JA, Phillips SM. High responders to resistance exercise training demonstrate differential regulation of skeletal muscle microRNA expression. J Appl Physiol (1985) 2011;110:309–17.
[39] Kim JS, Petrella JK, Cross JM, Bamman MM. Load-mediated downregulation of myostatin mRNA is not sufficient to promote myofiber hypertrophy in humans: a cluster analysis. J Appl Physiol (1985) 2007;103:1488–95.
[40] Stec MJ, Kelly NA, Many GM, Windham ST, Tuggle SC, Bamman MM. Ribosome biogenesis may augment resistance training-induced myofiber hypertrophy and is required for myotube growth in vitro. Am J Physiol Endocrinol Metab 2016;310(8):E652–E661. ajpendo 0048602015.
[41] Gentles JA, Phillips SM. Discrepancies in publications related to HMB-FA and ATP supplementation. Nutr Metab (Lond) 2017;14:42.
[42] Phillips SM, Aragon AA, Arciero PJ, Arent SM, Close GL, Hamilton DL, Helms ER, Henselmans M, Loenneke JP, Norton LE, Ormsbee MJ, Sale C, Schoenfeld BJ, SmithRyan AE, Tipton KD, Vukovich MD, Wilborn C, Willoughby DS. Changes in body composition and performance with supplemental HMB-FA+ATP. Strength Cond Res 2017;31(5):e71–e72.
[43] Thomson JS, Watson PE, Rowlands DS. Effects of nine weeks of beta-hydroxy-beta- methylbutyrate supplementation on strength and body composition in resistance trained men. J Strength Cond Res 2009;23:827–35.
[44] Wilkinson DJ, Hossain T, Limb MC, Phillips BE, Lund J, Williams JP, Brook MS, Cegielski J, Philp A, Ashcroft S, Rathmacher JA, Szewczyk NJ, Smith K, Atherton PJ. Impact of the calcium form of beta-hydroxy-beta-methylbutyrate upon human skeletal muscle protein metabo-lism. Clin Nutr 2017, https://doi.org/10.1016/j.clnu.2017.09.024.
[45] Kao M, Columbus DA, Suryawan A, Steinhoff-Wagner J, Hernandez-Garcia A, Nguyen HV, Fiorotto ML, Davis TA. Enteral beta-hydroxy-beta-methylbutyrate supplementation increases protein synthesis in skeletal muscle of neonatal pigs. Am J Physiol Endocrinol Metab 2016;310:E1072–84.
[46] Deutz NE, Pereira SL, Hays NP, Oliver JS, Edens NK, Evans CM, Wolfe RR. Effect of beta-hydroxy-beta-methylbutyrate (HMB) on lean body mass during 10 days of bed rest in older adults. Clin Nutr 2013;32:704–12.
[47] English KL, Mettler JA, Ellison JB, Mamerow MM, Arentson-Lantz E, Pattarini JM, Ploutz-Snyder R, Sheffield-Moore M, Paddon-Jones D. Leucine partially protects muscle mass and function during bed rest in middle-aged adults. Am J Clin Nutr 2016;103:465–73.
[48] Tscholl P, Alonso JM, Dolle G, Junge A, Dvorak J. The use of drugs and nutritional supplements in top-level track and field athletes. Am J Sports Med 2010;38:133–40.
[49] Williams MH, Branch JD. Creatine supplementation and exercise performance: an update. J Am Coll Nutr 1998;17:216–34.
[50] Lanhers C, Pereira B, Naughton G, Trousselard M, Lesage FX, Dutheil F. Creatine supplementation and upper limb strength performance: a systematic review and meta-analysis. Sports Med 2017;47:163–73.
[51] Burke DG, Chilibeck PD, Parise G, Candow DG, Mahoney D, Tarnopolsky M. Effect of creatine and weight training on muscle creatine and performance in vegetarians. Med Sci Sports Exerc 2003;35:1946–55.
[52] Kreider RB, Kalman DS, Antonio J, Ziegenfuss TN, Wildman R, Collins R, Candow DG, Kleiner SM, Almada AL, Lopez HL. International society of sports nutrition position stand: safety and efficacy of creatine supplementation in exercise, sport, and medicine. J Int Soc Sport Nutr 2017;14:18.
[53] Hultman E, Soderlund K, Timmons JA, Cederblad G, Greenhaff PL. Muscle creatine loading in men. J Appl Physiol (1985) 1996;81:232–7.
[54] Lanhers C, Pereira B, Naughton G, Trousselard M, Lesage FX, Dutheil F. Creatine supplementation and lower limb strength performance: a systematic review and meta-analyses. Sports Med 2015;45:1285–94.
[55] Rawson ES, Volek JS. Effects of creatine supplementation and resistance training on muscle strength and weightlifting performance. J Strength Cond Res 2003;17:822–31.
[56] Harris RC, Soderlund K, Hultman E. Elevation of creatine in resting and exercised muscle of normal subjects by creatine supplementation. Clin Sci (Lond) 1992;83:367–74.
[57] Candow DG, Chilibeck PD, Burke DG, Mueller KD, Lewis JD. Effect of different frequencies of creatine supplementation on muscle size and strength in young adults. J Strength Cond Res 2011;25:1831–8.
[58] Mihic S, MacDonald JR, McKenzie S, Tarnopolsky MA. Acute creatine loading increases fat-free mass, but does not affect blood pressure, plasma creatinine, or CK activity in men and women. Med Sci Sports Exerc 2000;32:291–6.
[59] Parise G, Mihic S, MacLennan D, Yarasheski KE, Tarnopolsky MA. Effects of acute creatine monohydrate supplementation on leucine kinet- ics and mixed-muscle protein synthesis. J Appl Physiol (1985) 2001;91:1041–7.
[60] Farshidfar F, Pinder MA, Myrie SB. Creatine supplementation and skeletal muscle metabolism for building muscle mass - review of the potential mechanisms of action. Curr Protein Pept Sci 2017;18:1273–87.
[61] Deldicque L, Louis M, Theisen D, Nielens H, Dehoux M, Thissen JP, Rennie MJ, Francaux M. Increased IGF mRNA in human skeletal muscle after creatine supplementation. Med Sci Sports Exerc 2005;37:731–6.
[62] Ham DJ, Caldow MK, Lynch GS, Koopman R. Arginine protects muscle cells from wasting in vitro in an mTORC1-dependent and NO-independent manner. Amino Acids 2014;46:2643–52.
[63] Deldicque L, Theisen D, Bertrand L, Hespel P, Hue L, Francaux M. Creatine enhances differentiation of myogenic C2C12 cells by activating both p38 and Akt/PKB pathways. Am J Physiol Cell Physiol 2007;293:C1263–71.
[64] Olsen S, Aagaard P, Kadi F, Tufekovic G, Verney J, Olesen JL, Suetta C, Kjaer M. Creatine supplementation augments the increase in satellite cell and myonuclei number in human skeletal muscle induced by strength training. J Physiol 2006;573:525–34.
[65] Petrella JK, Kim JS, Mayhew DL, Cross JM, Bamman MM. Potent myofiber hypertrophy during resistance training in humans is associated with satellite cell-mediated myonuclear addition: a cluster analysis. J Appl Physiol (1985) 2008;104:1736–42.
[66] Cornish SM, Chilibeck PD, Burke DG. The effect of creatine monohydrate supplementation on sprint skating in ice-hockey players. J Sports Med Phys Fit 2006;46:90–8.
[67] Dawson B, Vladich T, Blanksby BA. Effects of 4 weeks of creatine supplementation in junior swimmers on freestyle sprint and swim bench performance. J Strength Cond Res 2002;16:485–90.
[68] Juhasz I, Gyore I, Csende Z, Racz L, Tihanyi J. Creatine supplementation improves the anaerobic performance of elite junior fin swimmers. Acta Physiol Hung 2009;96:325–36.
[69] Poortmans JR, Francaux M. Adverse effects of creatine supplementation: fact or fiction? Sports Med 2000;30:155–70.
[70] Kutz MR, Gunter MJ. Creatine monohydrate supplementation on body weight and percent body fat. J Strength Cond Res 2003;17: 817–21.
[71] Dalbo VJ, Roberts MD, Stout JR, Kerksick CM. Putting to rest the myth of creatine supplementation leading to muscle cramps and dehydration. Br J Sports Med 2008;42:567–73.
[72] Baguet A, Koppo K, Pottier A, Derave W. Beta-alanine supplementation reduces acidosis but not oxygen uptake response during high-intensity cycling exercise. Eur J Appl Physiol 2010;108:495–503.
[73] Junge W, McLaughlin S. The role of fixed and mobile buffers in the kinetics of proton movement. Biochim Biophys Acta 1987;890:1–5.
[74] Boldyrev AA, Aldini G, Derave W. Physiology and pathophysiology of carnosine. Physiol Rev 2013;93:1803–45.
[75] Tanokura MTM, Miyazawa T. 1H nuclear magnetic resonance studies of histidine-containing di- and tripeptides. Estimation of the effects of charged groups on the pKa value of the imidazole ring. Biopolymers 1976;15:393–401.
[76] Harris RC, Wise JA, Price KA, Kim HJ, Kim CK, Sale C. Determinants of muscle carnosine content. Amino Acids 2012;43:5–12.
[77] Stellingwerff T, Anwander H, Egger A, Buehler T, Kreis R, Decombaz J, Boesch C. Effect of two beta-alanine dosing protocols on muscle carnosine synthesis and washout. Amino Acids 2012;42:2461–72.
[78] Mannion AF, Jakeman PM, Dunnett M, Harris RC, Willan PL. Carnosine and anserine concentrations in the quadriceps femoris muscle of healthy humans. Eur J Appl Physiol Occup Physiol 1992;64:47–50.
[79] del Favero S, Roschel H, Solis MY, Hayashi AP, Artioli GG, Otaduy MC, Benatti FB, Harris RC, Wise JA, Leite CC, Pereira RM, de Sa-Pinto AL, Lancha-Junior AH, Gualano B. Beta-alanine (Carnosyn) supplementation in elderly subjects (60-80 years): effects on muscle carnosine content and physical capacity. Amino Acids 2012;43:49–56.
[80] Harris RCJG, Hill CH, Kendrick IP, Boobis L, Kim CK, Kim HJ, Dang VH, Edge J, Wise JA. The carnosine content of V Lateralis in vegetarians and omnivores. FASEB J 2007;21.
[81] Tallon MJ, Harris RC, Maffulli N, Tarnopolsky MA. Carnosine, taurine and enzyme activities of human skeletal muscle fibres from elderly subjects with osteoarthritis and young moderately active subjects. Biogerontology 2007;8:129–37.
[82] Dutka TL, Lamboley CR, McKenna MJ, Murphy RM, Lamb GD. Effects of carnosine on contractile apparatus Ca(2)(+) sensitivity and sarcoplasmic reticulum Ca(2)(+) release in human skeletal muscle fibers. J Appl Physiol (1985) 2012;112:728–36.
[83] Harris RC, Tallon MJ, Dunnett M, Boobis L, Coakley J, Kim HJ, Fallowfield JL, Hill CA, Sale C, Wise JA. The absorption of orally supplied beta-alanine and its effect on muscle carnosine synthesis in human vastus lateralis. Amino Acids 2006;30:279–89.
[84] Everaert I, Mooyaart A, Baguet A, Zutinic A, Baelde H, Achten E, Taes Y, De Heer E, Derave W. Vegetarianism, female gender and increasing age, but not CNDP1 genotype, are associated with reduced muscle carnosine levels in humans. Amino Acids 2011;40:1221–9.
[85] Schiaffino S, Reggiani C. Fiber types in mammalian skeletal muscles. Physiol Rev 2011;91:1447–531.
[86] Parkhouse WS, McKenzie DC, Hochachka PW, Ovalle WK. Buffering capacity of deproteinized human vastus lateralis muscle. J Appl Physiol (1985) 1985;58:14–7.
[87] Trexler ET, Smith-Ryan AE, Stout JR, Hoffman JR, Wilborn CD, Sale C, Kreider RB, Jager R, Earnest CP, Bannock L, Campbell B, Kalman D, Ziegenfuss TN, Antonio J. International society of sports nutrition position stand: beta-alanine. J Int Soc Sports Nutr 2015;12:30.
[88] Decombaz J, Beaumont M, Vuichoud J, Bouisset F, Stellingwerff T. Effect of slow-release beta-alanine tablets on absorption kinetics and paresthesia. Amino Acids 2012;43:67–76.
[89] Stegen S, Blancquaert L, Everaert I, Bex T, Taes Y, Calders P, Achten E, Derave W. Meal and beta-alanine coingestion enhances muscle carnosine loading. Med Sci Sports Exerc 2013;45:1478–85.
[90] Stegen S, Bex T, Vervaet C, Vanhee L, Achten E, Derave W. Beta-alanine dose for maintaining moderately elevated muscle carnosine levels. Med Sci Sports Exerc 2014;46:1426–32.
[91] Baguet A, Reyngoudt H, Pottier A, Everaert I, Callens S, Achten E, Derave W. Carnosine loading and washout in human skeletal muscles. J Appl Physiol (1985) 2009;106:837–42.
[92] Hobson RM, Saunders B, Ball G, Harris RC, Sale C. Effects of beta-alanine supplementation on exercise performance: a meta-analysis. Amino Acids 2012;43:25–37.
[93] Sale C, Hill CA, Ponte J, Harris RC. Beta-alanine supplementation improves isometric endurance of the knee extensor muscles. J Int Soc Sports Nutr 2012;9:26.
[94] Hoffman JR, Ratamess NA, Faigenbaum AD, Ross R, Kang J, Stout JR, Wise JA. Short-duration beta-alanine supplementation increases training volume and reduces subjective feelings of fatigue in college football players. Nutr Res 2008;28:31–5.
[95] Rosas F, Ramirez-Campillo R, Martinez C, Caniuqueo A, Canas-Jamet R, McCrudden E, Meylan C, Moran J, Nakamura FY, Pereira LA, Loturco I, Diaz D, Izquierdo M. Effects of plyometric training and beta-alanine supplementation on maximal-intensity exercise and endur- ance in female soccer players. J Hum Kinet 2017;58:99–109.
[96] Carpentier A, Olbrechts N, Vieillevoye S, Poortmans JR. Beta-alanine supplementation slightly enhances repeated plyometric performance after high-intensity training in humans. Amino Acids 2015;47:1479–83.
[97] Derave W, Ozdemir MS, Harris RC, Pottier A, Reyngoudt H, Koppo K, Wise JA, Achten E. beta-Alanine supplementation augments muscle carnosine content and attenuates fatigue during repeated isokinetic contraction bouts in trained sprinters. J Appl Physiol (1985) 2007;103:1736–43.
[98] Kendrick IP, Harris RC, Kim HJ, Kim CK, Dang VH, Lam TQ, Bui TT, Smith M, Wise JA. The effects of 10 weeks of resistance training com- bined with beta-alanine supplementation on whole body strength, force production, muscular endurance and body composition. Amino Acids 2008;34:547–54.
[99] Kern BD, Robinson TL. Effects of beta-alanine supplementation on performance and body composition in collegiate wrestlers and football players. J Strength Cond Res 2011;25:1804–15.
[100] Glenn JM, Gray M, Stewart Jr RW, Moyen NE, Kavouras SA, DiBrezzo R, Turner R, Baum JI, Stone MS. Effects of 28-day beta-alanine supple- mentation on isokinetic exercise performance and body composition in female masters athletes. J Strength Cond Res 2016;30:200–7.
[101] Smith GI, Atherton P, Reeds DN, Mohammed BS, Rankin D, Rennie MJ, Mittendorfer B. Omega-3 polyunsaturated fatty acids augment the muscle protein anabolic response to hyperinsulinaemia-hyperaminoacidaemia in healthy young and middle-aged men and women. Clin Sci (Lond) 2011;121:267–78.
[102] Smith GI, Atherton P, Reeds DN, Mohammed BS, Rankin D, Rennie MJ, Mittendorfer B. Dietary omega-3 fatty acid supplementation increases the rate of muscle protein synthesis in older adults: a randomized controlled trial. Am J Clin Nutr 2011;93:402–12.
[103] Kamolrat T, Gray SR. The effect of eicosapentaenoic and docosahexaenoic acid on protein synthesis and breakdown in murine C2C12 myo- tubes. Biochem Biophys Res Commun 2013;432:593–8.
[104] Song Z, Moore DR, Hodson N, Ward C, Dent JR, O’Leary MF, Shaw AM, Hamilton DL, Sarkar S, Gangloff YG, Hornberger TA, Spriet LL, Heigenhauser GJ, Philp A. Resistance exercise initiates mechanistic target of rapamycin (mTOR) translocation and protein complex co- localisation in human skeletal muscle. Sci Rep 2017;7:5028.
[105] McGlory C, Wardle SL, Macnaughton LS, Witard OC, Scott F, Dick J, Bell JG, Phillips SM, Galloway SD, Hamilton DL, Tipton KD. Fish oil supplementation suppresses resistance exercise and feeding-induced increases in anabolic signaling without affecting myofibrillar protein synthesis in young men. Physiol Rep 2016;4.
[106] Da Boit M, Sibson R, Sivasubramaniam S, Meakin JR, Greig CA, Aspden RM, Thies F, Jeromson S, Hamilton DL, Speakman JR, Hambly C, Mangoni AA, Preston T, Gray SR. Sex differences in the effect of fish-oil supplementation on the adaptive response to resistance exercise training in older people: a randomized controlled trial. Am J Clin Nutr 2017;105:151–8.
[107] Rodacki CL, Rodacki AL, Pereira G, Naliwaiko K, Coelho I, Pequito D, Fernandes LC. Fish-oil supplementation enhances the effects of strength training in elderly women. Am J Clin Nutr 2012;95:428–36.
[108] Tsuchiya Y, Yanagimoto K, Nakazato K, Hayamizu K, Ochi E. Eicosapentaenoic and docosahexaenoic acids-rich fish oil supplementation attenuates strength loss and limited joint range of motion after eccentric contractions: a randomized, double-blind, placebo-controlled, parallel-group trial. Eur J Appl Physiol 2016;116:1179–88.
[109] Nissen S, Sharp R, Ray M, Rathmacher JA, Rice D, Fuller Jr JC, Connelly AS, Abumrad N. Effect of leucine metabolite beta-hydroxy-beta- methylbutyrate on muscle metabolism during resistance-exercise training. J Appl Physiol (1985) 1996;81(5):2095–104.
[110] Panton LB, Rathmacher JA, Baier S, Nissen S. Nutritional supplementation of the leucine metabolite beta-hydroxy-beta-methylbutyrate (hmb) during resistance training. Nutrition 2000;16(9):734–39.
[111] Jowko E, Ostaszewski P, Jank M, Sacharuk J, Zieniewicz A, Wilczak J, Nissen S. Creatine and beta-hydroxy-beta-methylbutyrate (HMB) additively increase lean body mass and muscle strength during a weight-training program. Nutrition 2001;17(7–8):558–66.
[112] Slater G, Jenkins D, Logan P, Lee H, Vukovich M, Rathmacher JA, Hahn AG. Beta-hydroxy-beta-methylbutyrate (HMB) supplementa- tion does not affect changes in strength or body composition during resistance training in trained men. Int J Sport Nutr Exerc Metab 2001;11(3):384–96.
[113] Kreider RB, Ferreira M, Wilson M, Almada AL. Effects of calcium beta-hydroxy-beta-methylbutyrate (HMB) supplementation during resistance-training on markers of catabolism, body composition and strength. Int J Sports Med 1999;20(8):503–9.



 La nutrition pour l’amélioration de la force :
La nutrition pour l’amélioration de la force :