Introduction
L’hypertrophie musculaire est finalement le résultat de périodes cumulatives de bilan protéique net positif, c’est-à-dire la synthèse de protéines musculaires (MPS) dépassant la dégradation des protéines musculaires (MPB). Les exercices de renforcement (ER) et l'apport en protéines stimulent la MPS, la rendant supérieure à la MPB. L'augmentation de la MPS post-ER est particulièrement forte au début d'un traitement par RT (resistance training), en raison du stress élevé imposé par des RE inhabituels. Ce stress se reflète également par l'ampleur des dommages musculaires nettement plus importants après la première séance de RT que par la suite
Objectif
Cet article a pour objectif objectif d’évaluer de manière critique la littérature afin de déterminer en quoi des séances de RT répétées contribuent à l’accumulation de protéines myofibrillaires dans le muscle squelettique ainsi que le rôle des dommages musculaires dans la médiation de l’hypertrophie du muscle squelettique.
Dommages musculaires induits par l'exercice
Le stress initial induit par l'ER (c'est-à-dire à l'état non entraîné) affecte l'homéostasie musculaire et des modifications de la morphologie musculaire, telles que des perturbations du cytosquelette (ex : la perturbation des bandes Z), la perte de protéines structurales sarcomériques (ex : la desmine et la dystrophine), une nécrose segmentaire des fibres musculaires, des altérations du tissu conjonctif, ainsi que des tubules T et réticulum sarcoplasmique. Ces modifications de la morphologie musculaire peuvent être une conséquence directe du stress mécanique induit par l'exercice ou ultérieurement de l'activation des voies de dégradation et de la réponse inflammatoire sensibles au calcium. Pour bien caractériser l’ampleur des lésions musculaires induites par l’exercice et du processus de récupération, il convient d’évaluer les symptômes associés (marqueurs indirectes) tels que la perte de capacité fonctionnelle, le gonflement musculaire induit par un œdème, la douleur musculaire à l’apparition retardée (DOMS) et la perte de protéines musculaires.
Des diminutions de la fonction musculaire (ex : la force et / ou la puissance) ont été largement utilisées dans la littérature et considérées comme le meilleur marqueur indirect des lésions musculaires. Les diminutions de la force musculaire sont corrélées au niveau de perturbations des bandes Z après protocole induisant des lésions musculaires, reflétant mieux l'ampleur de la perturbation myofibrillaire, de l'inflammation et de la nécrose que tout autre marqueur indirect En outre, la réduction de la force musculaire est considérée comme un indicateur du remodelage de la matrice extracellulaire ou de l'échec du couplage excitation-contraction.
Le gonflement musculaire induit par l'œdème peut être estimé en mesurant les changements de la circonférence des membres, de l'épaisseur du muscle ou du CSA mesuré par imagerie (ultrasons ou par résonance magnétique (IRM)). On obtient généralement une bonne estimation indirecte de l’œdème en analysant l’intensité de l’écho musculaire et le temps de relaxation IRM T2. Cette approche permet de détecter les modifications du contenu en liquide musculaire.
Les DOMS sont sans doute considéré comme le marqueur le plus pratique pour la mise en évidence des dommages musculaires, car il peut être facilement évalué par des échelles visuelles dans lesquelles les participants marquent leur niveau perçu de douleur musculaire dans différentes conditions (à savoir au repos, au mouvement ou à la palpation)
En outre, la fuite de protéines musculaires telles que la CK (créatine kinase) et la myoglobine (Mb) dans le sang a également été largement utilisée comme marqueur indirect de lésions musculaires reflétant l'augmentation de la perméabilité sarcolémique induite par l'exercice.
Enfin, après l’exercice, les niveaux de certaines cytokines présentes dans le sang, (ex : TNF-α, IL-1β et IL-6), indiquent une réaction inflammatoire correspondant aux lésions musculaires induites par l'exercice
L’hypertrophie musculaire est finalement le résultat de périodes cumulatives de bilan protéique net positif, c’est-à-dire la synthèse de protéines musculaires (MPS) dépassant la dégradation des protéines musculaires (MPB). Les exercices de renforcement (ER) et l'apport en protéines stimulent la MPS, la rendant supérieure à la MPB. L'augmentation de la MPS post-ER est particulièrement forte au début d'un traitement par RT (resistance training), en raison du stress élevé imposé par des RE inhabituels. Ce stress se reflète également par l'ampleur des dommages musculaires nettement plus importants après la première séance de RT que par la suite
Objectif
Cet article a pour objectif objectif d’évaluer de manière critique la littérature afin de déterminer en quoi des séances de RT répétées contribuent à l’accumulation de protéines myofibrillaires dans le muscle squelettique ainsi que le rôle des dommages musculaires dans la médiation de l’hypertrophie du muscle squelettique.
Dommages musculaires induits par l'exercice
Le stress initial induit par l'ER (c'est-à-dire à l'état non entraîné) affecte l'homéostasie musculaire et des modifications de la morphologie musculaire, telles que des perturbations du cytosquelette (ex : la perturbation des bandes Z), la perte de protéines structurales sarcomériques (ex : la desmine et la dystrophine), une nécrose segmentaire des fibres musculaires, des altérations du tissu conjonctif, ainsi que des tubules T et réticulum sarcoplasmique. Ces modifications de la morphologie musculaire peuvent être une conséquence directe du stress mécanique induit par l'exercice ou ultérieurement de l'activation des voies de dégradation et de la réponse inflammatoire sensibles au calcium. Pour bien caractériser l’ampleur des lésions musculaires induites par l’exercice et du processus de récupération, il convient d’évaluer les symptômes associés (marqueurs indirectes) tels que la perte de capacité fonctionnelle, le gonflement musculaire induit par un œdème, la douleur musculaire à l’apparition retardée (DOMS) et la perte de protéines musculaires.
Des diminutions de la fonction musculaire (ex : la force et / ou la puissance) ont été largement utilisées dans la littérature et considérées comme le meilleur marqueur indirect des lésions musculaires. Les diminutions de la force musculaire sont corrélées au niveau de perturbations des bandes Z après protocole induisant des lésions musculaires, reflétant mieux l'ampleur de la perturbation myofibrillaire, de l'inflammation et de la nécrose que tout autre marqueur indirect En outre, la réduction de la force musculaire est considérée comme un indicateur du remodelage de la matrice extracellulaire ou de l'échec du couplage excitation-contraction.
Le gonflement musculaire induit par l'œdème peut être estimé en mesurant les changements de la circonférence des membres, de l'épaisseur du muscle ou du CSA mesuré par imagerie (ultrasons ou par résonance magnétique (IRM)). On obtient généralement une bonne estimation indirecte de l’œdème en analysant l’intensité de l’écho musculaire et le temps de relaxation IRM T2. Cette approche permet de détecter les modifications du contenu en liquide musculaire.
Les DOMS sont sans doute considéré comme le marqueur le plus pratique pour la mise en évidence des dommages musculaires, car il peut être facilement évalué par des échelles visuelles dans lesquelles les participants marquent leur niveau perçu de douleur musculaire dans différentes conditions (à savoir au repos, au mouvement ou à la palpation)
En outre, la fuite de protéines musculaires telles que la CK (créatine kinase) et la myoglobine (Mb) dans le sang a également été largement utilisée comme marqueur indirect de lésions musculaires reflétant l'augmentation de la perméabilité sarcolémique induite par l'exercice.
Enfin, après l’exercice, les niveaux de certaines cytokines présentes dans le sang, (ex : TNF-α, IL-1β et IL-6), indiquent une réaction inflammatoire correspondant aux lésions musculaires induites par l'exercice
Des augmentations précoces de la surface transversale des muscles indiquent-elles une hypertrophie réelle ou un gonflement musculaire principalement dû à un œdème?
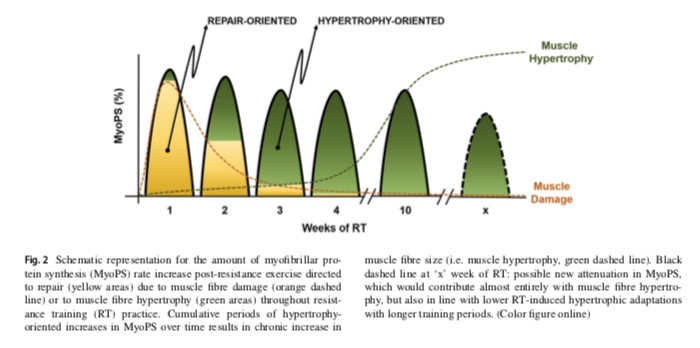
Il a récemment été démontré que très tôt dans la RT, de petites augmentations du CSA musculaire (environ 2,7%) sont principalement attribuées au gonflement musculaire induit par un œdème et non à la véritable hypertrophie musculaire. En pratique, le temps minimum pour la mise en place d’une hypertrophie réelle dans un scénario d’entraînement reste à déterminer. La figure 1 représente la contribution de l'œdème en réponse au RT aux changements globaux du CSA et au développement de l'hypertrophie musculaire. Une petite proportion de l’ hypertrophie musculaire se produit tôt dans le RT, mais le nombre de séances de RT requises et la fenêtre temporelle nécessaire pour détecter réellement l'augmentation de la taille musculaire à l'aide des technologies disponibles sont inconnus. La littérature actuelle montre que:
Il a récemment été démontré que très tôt dans la RT, de petites augmentations du CSA musculaire (environ 2,7%) sont principalement attribuées au gonflement musculaire induit par un œdème et non à la véritable hypertrophie musculaire. En pratique, le temps minimum pour la mise en place d’une hypertrophie réelle dans un scénario d’entraînement reste à déterminer. La figure 1 représente la contribution de l'œdème en réponse au RT aux changements globaux du CSA et au développement de l'hypertrophie musculaire. Une petite proportion de l’ hypertrophie musculaire se produit tôt dans le RT, mais le nombre de séances de RT requises et la fenêtre temporelle nécessaire pour détecter réellement l'augmentation de la taille musculaire à l'aide des technologies disponibles sont inconnus. La littérature actuelle montre que:
- les augmentations très précoces du CSA musculaire favorisée par environ 4 ER sont principalement imputables à un gonflement;
- après environ 8 à 12 séances de RT, une légère amplitude d'hypertrophie musculaire (environ 3 à 4% de l'hypertrophie vraie) peut être détectée;
- après environ 18 sessions de RT, effectuées sur 6-10 semaines de RT, sont assez pour promouvoir une hypertrophie musculaire vraie et fonctionnellement significative (~ 7-10%).
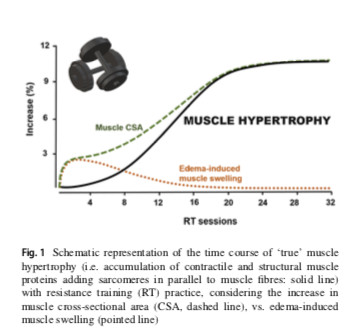
Modulations sur les lésions musculaires et la synthèse des protéines musculaires par l'entraînement en résistance et leur rôle déterminant dans l'hypertrophie musculaire
Les modifications de la MPS consécutives à l'ER sont considérées comme le principal facteur responsable de l'accrétion de la protéine dans le tissu musculaire. Fait intéressant, la cinétique de la MPS augmente après chaque session RT au cours d'un programme d'entraînement. Chez un sujet non entrainé, la MPS atteint son apogée plus tard, mais reste élevée plus longtemps après l'ER, ce qui entraîne une augmentation globale de la MPS plus élevée après l'ER par rapport à un sujet entrainé. Cette augmentation plus importante de la synthèse des protéines dans un état non entraîné pourrait être partiellement due à la survenue de lésions musculaires. En effet, les dommages musculaires sont les plus importants après la 1ère séance de RT mais s'atténuent progressivement tout au long d'un programme de RT. Dans un état formé, il a été prouvé que les individus hautement qualifiés en ER (expérience de 9 ans) n'augmentent pas la phosphorylation de l'AMPK après une session d'ER, un fait observé également chez les cyclistes hautement qualifiés (expérience de 8 ans) après un entrainement de vélo. À l’inverse, lorsque les mêmes sujets formés ont entrepris un entrainement dans leur activité non familière (c’est-à-dire un exercice vélo pour les sujets entraînés au renforcement et une ER pour les cyclistes entraînés), la phosphorylation de l’AMPK a augmenté.
Les modifications de la MPS consécutives à l'ER sont considérées comme le principal facteur responsable de l'accrétion de la protéine dans le tissu musculaire. Fait intéressant, la cinétique de la MPS augmente après chaque session RT au cours d'un programme d'entraînement. Chez un sujet non entrainé, la MPS atteint son apogée plus tard, mais reste élevée plus longtemps après l'ER, ce qui entraîne une augmentation globale de la MPS plus élevée après l'ER par rapport à un sujet entrainé. Cette augmentation plus importante de la synthèse des protéines dans un état non entraîné pourrait être partiellement due à la survenue de lésions musculaires. En effet, les dommages musculaires sont les plus importants après la 1ère séance de RT mais s'atténuent progressivement tout au long d'un programme de RT. Dans un état formé, il a été prouvé que les individus hautement qualifiés en ER (expérience de 9 ans) n'augmentent pas la phosphorylation de l'AMPK après une session d'ER, un fait observé également chez les cyclistes hautement qualifiés (expérience de 8 ans) après un entrainement de vélo. À l’inverse, lorsque les mêmes sujets formés ont entrepris un entrainement dans leur activité non familière (c’est-à-dire un exercice vélo pour les sujets entraînés au renforcement et une ER pour les cyclistes entraînés), la phosphorylation de l’AMPK a augmenté.
- Ainsi, la phosphorylation de l'AMPK semble davantage liée à l'impact du stress de l'exercice sur les muscles que le mode de l'exercice.
- En conséquence, avec la progression de la RT, les augmentations de MyoPS (synthèse de protéines myofibrillaires) et de MPB s’atténuent, et MyoPS est en corrélation avec les augmentations éventuelles de la fCSA (CSA fibrillaire) et de la CSA musculaire, c'est-à-dire l'hypertrophie musculaire, induites par la RT. La figure 2 fournit un modèle théorique englobant les processus susmentionnés.
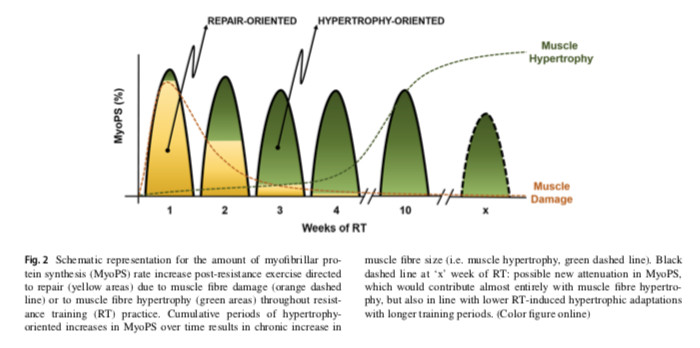
Dans l'ensemble, il est raisonnable de penser que les lésions musculaires n'expliquent ni ne renforcent les réponses hypertrophiques musculaires. Plusieurs études n’ont mis en évidence aucune différence de réponse de l’hypertrophie musculaire après des semaines de RT entre uniquement excentrique par rapport à la RT concentrique uniquement malgré le fait que les ER excentriques induisent des dommages musculaires plus importants. Ces résultats ne sont pas universels. Bien que les lésions musculaires ne semblent pas expliquer ni potentialiser l'hypertrophie musculaire avec la RT, il reste à déterminer si des lésions musculaires sont nécessaires pour soutenir les gains futurs de masse musculaire. La survenue de lésions musculaires sévères, caractérisées par une perte de protéines structurelles et une nécrose segmentaire peut compromettre l’hypertrophie musculaire. De manière pratique, les précédentes des données démystifient le concept «no pain, no gain», indiquant que le «gain» (hypertrophie musculaire) peut survenir en l’absence de «douleur» (DOMS); et des données précédentes étendent cette notion en montrant que c’est en réalité lorsque vous ressentez moins de «douleur» que vous commencez à «gagner».
- Les marqueurs indirects de lésions musculaires, tels que les DOMS, la fuite de CK dans le sang ou une diminution importante de la force ne sont pas nécessaires pour précéder l'hypertrophie musculaire (Fig. 3).
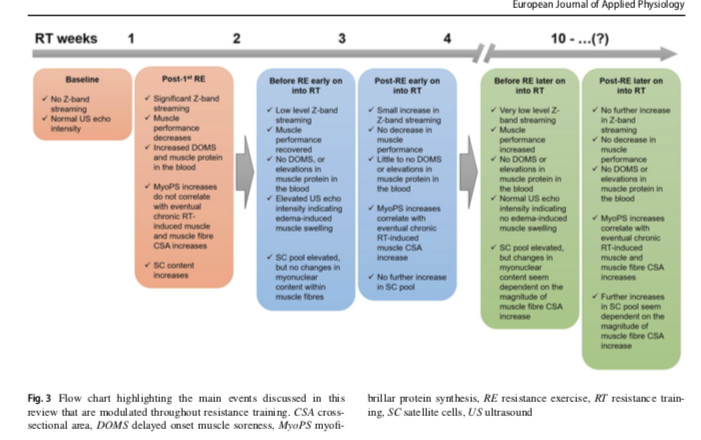
Cellules satellites (SC)
Les cellules souches musculaires multipotentes et mononucléées, situées entre la lame basale et le sarcolemme du muscle, sont appelées SC (Mauro 1961). Après stimulation, les SC quittent leur état de repos. Les SC activées se mettent à exprimer une protéine de détermination myoblastique (MyoD). Après la prolifération, certains SC retrouvent leur état de repos, ou subissent le cycle myogénique en se différenciant et fusionnent éventuellement avec les fibres musculaires, en donnant leur noyau et en augmentant la capacité de transcription des fibres musculaires. Les dommages musculaires constituent l'un des principaux stimuli pour activer la SC. Il a été montré que 24 heures après une lésion musculaire induite par l'ER, il y avait
Les sessions répétées d'ER maintiennent un contenu accru de SC au fil du temps, en tant que mécanisme d'anticipation éventuel pour supporter de futurs événements stressants. Chez l'homme, il a été prouvé qu'au début de l'hypertrophie musculaire, les myonucléés existants augmenteraient la capacité transcriptionnelle favorisant la croissance initiale des fibres musculaires et, lorsque le volume du cytoplasme des fibres deviendrait trop important pour être contrôlé par des myonucléés antérieurs, les SC donneraient leurs noyaux aux fibres musculaires. Les SC sont impliqués dans la réparation du muscle squelettique après des dommages induits par l'exercice. Si les dommages sont sévères, les SC se différencient et aident à la régénération des tissus; si les lésions sont légères à modérées, la SC pourrait contribuer au remaniement des myonoyaux et au remodelage des composants extracellulaires musculaires. La répétition chronique de l'ER maintiendra l'élévation des SC, reconstituant son pool et renforçant la capacité myogénique en cas de futurs événements stressants ou d'hypertrophie des fibres musculaires. Dans un état entraîné, une hypertrophie importante des fibres musculaires due à une RT continue semble être nécessaire pour induire une nouvelle augmentation des SC post-ER et une augmentation chronique du contenu myonucléaire.
Conclusions
Article original
The development of skeletal muscle hypertrophy through resistance training: the role of muscle damage and muscle protein synthesis, Felipe Damas et Al. Eruopean Journal of applied physiology, December 2017, Doi : 10.1007/s00421-017-3792-9
Les cellules souches musculaires multipotentes et mononucléées, situées entre la lame basale et le sarcolemme du muscle, sont appelées SC (Mauro 1961). Après stimulation, les SC quittent leur état de repos. Les SC activées se mettent à exprimer une protéine de détermination myoblastique (MyoD). Après la prolifération, certains SC retrouvent leur état de repos, ou subissent le cycle myogénique en se différenciant et fusionnent éventuellement avec les fibres musculaires, en donnant leur noyau et en augmentant la capacité de transcription des fibres musculaires. Les dommages musculaires constituent l'un des principaux stimuli pour activer la SC. Il a été montré que 24 heures après une lésion musculaire induite par l'ER, il y avait
- une augmentation de 32% des SC dans la phase G0 / G1 du cycle cellulaire (dans laquelle SC deviennent actifs en synthétisant l'ARNm et les protéines pour la mitose ultérieure),
- une augmentation de 59% des SC dans la phase S (phase de synthèse, dans laquelle les SC répliquent de l’ADN),
- une augmentation de 202% du nombre de SC dans la phase G2 / M du cycle cellulaire (dans laquelle la synthèse des protéines et la croissance cellulaire sont fortement activées pour préparer les cellules à la mitose, c'est-à-dire la dernière phase du cycle cellulaire avant la prolifération).
Les sessions répétées d'ER maintiennent un contenu accru de SC au fil du temps, en tant que mécanisme d'anticipation éventuel pour supporter de futurs événements stressants. Chez l'homme, il a été prouvé qu'au début de l'hypertrophie musculaire, les myonucléés existants augmenteraient la capacité transcriptionnelle favorisant la croissance initiale des fibres musculaires et, lorsque le volume du cytoplasme des fibres deviendrait trop important pour être contrôlé par des myonucléés antérieurs, les SC donneraient leurs noyaux aux fibres musculaires. Les SC sont impliqués dans la réparation du muscle squelettique après des dommages induits par l'exercice. Si les dommages sont sévères, les SC se différencient et aident à la régénération des tissus; si les lésions sont légères à modérées, la SC pourrait contribuer au remaniement des myonoyaux et au remodelage des composants extracellulaires musculaires. La répétition chronique de l'ER maintiendra l'élévation des SC, reconstituant son pool et renforçant la capacité myogénique en cas de futurs événements stressants ou d'hypertrophie des fibres musculaires. Dans un état entraîné, une hypertrophie importante des fibres musculaires due à une RT continue semble être nécessaire pour induire une nouvelle augmentation des SC post-ER et une augmentation chronique du contenu myonucléaire.
Conclusions
- Le nombre précis de séances de RT ou le laps de temps nécessaire pour parvenir à une véritable hypertrophie reste discutable
- les augmentations du CSA musculaire aux alentours de 4 séances de RT sont principalement imputables à l'œdème musculaire.
- après environ 8 à 12 séances de RT, qu’une hypertrophie musculaire modérée peut être détectée et environ 18 séances de RT, effectuées sur une période de 6 à 10 semaines de RT, semblent favoriser une hypertrophie musculaire importante.
- Les lésions musculaires initiales induites par la RT conduisent éventuellement MyoPS vers le remodelage musculaire et non vers l'hypertrophie. Les dommages musculaires et les MyoPS sont atténués dès le début de la RT, même lorsque l’on prend en compte des dommages distincts de magnitude initiale.
- Avec la diminution progressive des dommages musculaires tout au long de la RT (effet de la répétition), l'augmentation de MyoPS après chaque RT peut contribuer à une augmentation de la masse musculaire.
- C’est dans un état entraîné, dans lequel les dommages musculaires sont minimes, que l'augmentation de MyoPS post-RE est fortement corrélée à l'hypertrophie musculaire favorisée par des semaines de RT.
- les protocoles d'ER qui ne provoquent pas de dommages musculaires importants au début de la RT, induisent toujours une hypertrophie musculaire et des gains de force similaires au fil du temps, par rapport aux conditions favorisant des dommages musculaires initiaux importants. Ainsi, bien que les lésions musculaires initiales (si elles ne sont pas graves) ne semblent pas altérer l'hypertrophie musculaire induite par les semaines de RT, les lésions musculaires n'expliquent, ni ne potentialisent les augmentations de la fCSA et du CSA musculaire; elles ne doivent donc pas être considérées comme un facteur déterminant de l'hypertrophie musculaire induite par la RT.
- Les SC jouent un rôle majeur dans la réparation des tissus après la survenue de lésions musculaires, probablement avec des rôles différents en fonction de la gravité des lésions musculaires induites par l'ER. Le RT maintient l’élévation du contenu du SC, reconstitue le pool de SC et renforce la capacité myogénique. De nouvelles augmentations du contenu en SC post-ER dans un état entraîné et des augmentations chroniques du nombre de myonoyau dans les fibres musculaires semblent dépendre de l'ampleur de l'augmentation de la fCSA induite par la RT.
Article original
The development of skeletal muscle hypertrophy through resistance training: the role of muscle damage and muscle protein synthesis, Felipe Damas et Al. Eruopean Journal of applied physiology, December 2017, Doi : 10.1007/s00421-017-3792-9
Références
Abraham WM (1977) Factors in delayed muscle soreness. Med Sci Sports 9:11–20
Ackley BJ, Swan BA, Ladwig G, Tucker S (2008) Evidence-based nursing care guidelines: medical-surgical interventions. Mosby Elsevier, St. Louis
Ahtiainen JP, Pakarinen A, Kraemer WJ, Hakkinen K (2003) Acute hormonal and neuromuscular responses and recovery to forced vs maximum repetitions multiple resistance exercises. Int J Sports Med 24:410–418. https://doi.org/10.1055/s-2003-41171
Ahtiainen JP, Pakarinen A, Alen M, Kraemer WJ, Hakkinen K (2005) Short vs. long rest period between the sets in hypertrophic resist- ance training: influence on muscle strength, size, and hormonal adaptations in trained men. J Strength Cond Res 19:572–582
Ahtiainen JP, Hoffren M, Hulmi JJ, Pietikainen M, Mero AA, Avela J, Hakkinen K (2010) Panoramic ultrasonography is a valid
method to measure changes in skeletal muscle cross-sectional area. Eur J Appl Physiol 108:273–279. https://doi.org/10.1007/ s00421-009-1211-6
Alexakis C, Partridge T, Bou-Gharios G (2007) Implication of the satellite cell in dystrophic muscle fibrosis: a self-perpetu- ating mechanism of collagen overproduction. Am J Phys- iol Cell Physiol 293:C661–C669. https://doi.org/10.1152/ ajpcell.00061.2007
Andersen LL, Andersen JL, Suetta C, Kjaer M, Sogaard K, Sjogaard G (2009) Effect of contrasting physical exercise interven- tions on rapid force capacity of chronically painful muscles. J Appl Physiol (1985) 107:1413–1419. https://doi.org/10.1152/ japplphysiol.00555.2009
Arts IM et al (2012) Intramuscular fibrous tissue determines muscle echo intensity in amyotrophic lateral sclerosis. Muscle Nerve 45:449–450. https://doi.org/10.1002/mus.22254
Aschenbach WG, Sakamoto K, Goodyear LJ (2004) 5′ adenosine monophosphate-activated protein kinase, metabolism and exer- cise. Sports Med 34:91–103
Atherton PJ, Smith K (2012) Muscle protein synthesis in response to nutrition and exercise. J Physiol 590:1049–1057. https://doi. org/10.1113/jphysiol.2011.225003
Atherton PJ, Babraj J, Smith K, Singh J, Rennie MJ, Wackerhage H (2005) Selective activation of AMPK-PGC-1alpha or PKB- TSC2-mTOR signaling can explain specific adaptive responses to endurance or resistance training-like electrical muscle stimula- tion. FASEB J 19:786–788. https://doi.org/10.1096/fj.04-2179fje
Bamman MM, Roberts BM, Adams GR (2017) Molecular regulation of exercise-induced muscle fiber hypertrophy. Cold Spring Harb Perspect Med. https://doi.org/10.1101/cshperspect.a029751
Beaton LJ, Tarnopolsky MA, Phillips SM (2002a) Contraction-induced muscle damage in humans following calcium channel blocker administration. J Physiol 544:849–859 pii]
Beaton LJ, Tarnopolsky MA, Phillips SM (2002b) Variability in esti- mating eccentric contraction-induced muscle damage and inflam- mation in humans. Can J Appl Physiol 27:516–526
Bellamy LM et al (2014) The acute satellite cell response and skeletal muscle hypertrophy following resistance training. PLoS One 9:e109739. https://doi.org/10.1371/journal.pone.0109739
Biolo G, Maggi SP, Williams BD, Tipton KD, Wolfe RR (1995) Increased rates of muscle protein turnover and amino acid transport after resistance exercise in humans. Am J Physiol 268:E514–E520
Biolo G, Tipton KD, Klein S, Wolfe RR (1997) An abundant supply of amino acids enhances the metabolic effect of exercise on muscle protein. Am J Physiol 273:E122–E129
Blazevich AJ, Cannavan D, Coleman DR, Horne S (2007) Influ- ence of concentric and eccentric resistance training on archi- tectural adaptation in human quadriceps muscles. J Appl Physiol (1985) 103:1565–1575. https://doi.org/10.1152/ japplphysiol.00578.2007
Bodine SC (2006) mTOR signaling and the molecular adaptation to resistance exercise. Med Sci Sports Exerc 38:1950–1957. https:// doi.org/10.1249/01.mss.0000233797.24035.35
Bolster DR, Crozier SJ, Kimball SR, Jefferson LS (2002) AMP-acti- vated protein kinase suppresses protein synthesis in rat skeletal muscle through down-regulated mammalian target of rapamycin (mTOR) signaling. J Biol Chem 277:23977–23980. https://doi. org/10.1074/jbc.C200171200
Brandenburg JP, Docherty D (2002) The effects of accentuated eccen- tric loading on strength, muscle hypertrophy, and neural adapta- tions in trained individuals. J Strength Cond Res 16:25–32
Brook MS et al (2015) Skeletal muscle hypertrophy adaptations pre- dominate in the early stages of resistance exercise training, matching deuterium oxide-derived measures of muscle pro- tein synthesis and mechanistic target of rapamycin complex 1 signaling. FASEB J 29:4485–4496. https://doi.org/10.1096/
fj.15-273755
Buckner SL et al (2017) Differentiating swelling and hypertrophy through indirect assessment of muscle damage in untrained men following repeated bouts of resistance exercise. Eur J Appl Phys- iol 117:213–224. https://doi.org/10.1007/s00421-016-3521-9
Butterfield TA (2010) Eccentric exercise in vivo: strain-induced muscle damage and adaptation in a stable system. Exerc Sport Sci Rev 38:51–60. https://doi.org/10.1097/JES.0b013e3181d496eb
Cao Y, Zhao Z, Gruszczynska-Biegala J, Zolkiewska A (2003) Role of metalloprotease disintegrin ADAM12 in determination of quies- cent reserve cells during myogenic differentiation in vitro. Mol Cell Biol 23:6725–6738
Chapman DW, Newton MJ, McGuigan MR, Nosaka K (2011) Effect of slow-velocity lengthening contractions on muscle damage induced by fast-velocity lengthening contractions. J Strength Cond Res 25:211–219. https://doi.org/10.1519/ JSC.0b013e3181bac2bd
Cheek DB (1985) The control of cell mass and replication. The DNA unit—a personal 20-year study. Early Hum Dev 12:211–239
Chen TC, Nosaka K (2006) Responses of elbow flexors to two strenu- ous eccentric exercise bouts separated by three days. J Strength Cond Res 20:108–116. https://doi.org/10.1519/R-16634.1
Chen TC, Chen HL, Lin MJ, Wu CJ, Nosaka K (2009) Muscle damage responses of the elbow flexors to four maximal eccentric exercise bouts performed every 4 weeks. Eur J Appl Physiol 106:267– 275. https://doi.org/10.1007/s00421-009-1016-7
Chen HL, Nosaka K, Pearce AJ, Chen TC (2012a) Two maximal isometric contractions attenuate the magnitude of eccentric exercise-induced muscle damage. Appl Physiol Nutr Metab 37:680–689. https://doi.org/10.1139/h2012-035
Chen TC, Chen HL, Pearce AJ, Nosaka K (2012b) Attenuation of eccentric exercise-induced muscle damage by preconditioning exercises. Med Sci Sports Exerc 44:2090–2098. https://doi. org/10.1249/MSS.0b013e31825f69f3
Chen TC, Chen HL, Lin MJ, Chen CH, Pearce AJ, Nosaka K (2013) Effect of two maximal isometric contractions on eccen- tric exercise-induced muscle damage of the elbow flexors. Eur J Appl Physiol 113:1545–1554. https://doi.org/10.1007/ s00421-012-2581-8
Clarkson PM, Hubal MJ (2002) Exercise-induced muscle damage in humans. Am J Phys Med Rehabil 81:S52–S69. https://doi. org/10.1097/01.PHM.0000029772.45258.43
Coffey VG, Zhong Z, Shield A, Canny BJ, Chibalin AV, Zierath JR, Hawley JA (2006) Early signaling responses to divergent exercise stimuli in skeletal muscle from well-trained humans. FASEB J 20:190–192. https://doi.org/10.1096/fj.05-4809fje
Conceicao MS et al (2012) Effects of eccentric exercise on systemic concentrations of pro- and anti-inflammatory cytokines and prostaglandin (E2): comparison between young and postmeno- pausal women. Eur J Appl Physiol 112:3205–3213. https://doi. org/10.1007/s00421-011-2292-6
Counts BR, Buckner SL, Mouser JG, Dankel SJ, Jessee MB, Mattocks KT, Loenneke JP (2017) Muscle growth: to infinity and beyond? Muscle Nerve. https://doi.org/10.1002/mus.25696
Cramer JT, Palmer IJ, Ryan ED, Herda TJ, Bemben DA, Bemben MG, Stratemeier PH (2007) Validity and reliability of a peripheral quantitative computed tomography scanner for measuring muscle cross-sectional area. Annual Meeting of the American College of Sports Medicine, Medicine and Science in Sports and Exercise 39(Supplement), New Orleans
Damas F, Phillips S, Vechin FC, Ugrinowitsch C (2015) A review of resistance training-induced changes in skeletal muscle pro- tein synthesis and their contribution to hypertrophy. Sports Med 45:801–807. https://doi.org/10.1007/s40279-015-0320-0
Damas F, Nosaka K, Libardi CA, Chen TC, Ugrinowitsch C (2016a) Susceptibility to exercise-induced muscle damage: a cluster anal- ysis with a large sample. Int J Sports Med 37:633–640. https:// doi.org/10.1055/s-0042-100281
Damas F et al (2016b) Resistance training-induced changes in inte- grated myofibrillar protein synthesis are related to hypertrophy only after attenuation of muscle damage. J Physiol 594:5209– 5222. https://doi.org/10.1113/JP272472
Damas F et al (2016c) Early resistance training-induced increases in muscle cross-sectional area are concomitant with edema-induced muscle swelling. Eur J Appl Physiol 116:49–56. https://doi. org/10.1007/s00421-015-3243-4
Damas F et al (2016d) An inability to distinguish edematous swell- ing from true hypertrophy still prevents a completely accu- rate interpretation of the time course of muscle hypertrophy. Eur J Appl Physiol 116:445–446. https://doi.org/10.1007/ s00421-015-3287-5
Damas F et al (under review) Early- and later-phases satellite cell responses and myonuclear content with resistance training in young men
DeFreitas JM, Beck TW, Stock MS, Dillon MA, Kasishke PR 2nd (2011) An examination of the time course of training-induced skeletal muscle hypertrophy. Eur J Appl Physiol 111:2785–2790. https://doi.org/10.1007/s00421-011-1905-4
DeFreitas JM, Beck TW, Stock MS (2016) The findings of Damas et al. have not influenced the previously proposed time course of skeletal muscle hypertrophy. Eur J Appl Physiol 116:443–444. https://doi.org/10.1007/s00421-015-3286-6
Doma K, Leicht A, Sinclair W, Schumann M, Damas F, Burt D, Woods C (2017) The impact of exercise-induced muscle damage on performance test outcomes in elite female basket- ball players. J Strength Cond Res. https://doi.org/10.1519/ JSC.0000000000002244
Douglas J, Pearson S, Ross A, McGuigan M (2017) Chronic adap- tations to eccentric training: a systematic review. Sports Med 47:917–941. https://doi.org/10.1007/s40279-016-0628-4
Dreyer HC, Fujita S, Cadenas JG, Chinkes DL, Volpi E, Rasmussen BB (2006) Resistance exercise increases AMPK activity and reduces 4E-BP1 phosphorylation and protein synthesis in human skeletal muscle. J Physiol 576:613–624. https://doi.org/10.1113/ jphysiol.2006.113175
Egner IM, Bruusgaard JC, Gundersen K (2016) Satellite cell deple- tion prevents fiber hypertrophy in skeletal muscle. Development 143:2898–2906. https://doi.org/10.1242/dev.134411
Eriksson A, Lindstrom M, Carlsson L, Thornell LE (2006) Hyper- trophic muscle fibers with fissures in power-lifters; fiber split- ting or defect regeneration? Histochem Cell Biol 126:409–417. https://doi.org/10.1007/s00418-006-0176-3
Farthing JP, Chilibeck PD (2003) The effects of eccentric and con- centric training at different velocities on muscle hypertro- phy. Eur J Appl Physiol 89:578–586. https://doi.org/10.1007/ s00421-003-0842-2
Farup J, Rahbek SK, Riis S, Vendelbo MH, Paoli F, Vissing K (2014a) Influence of exercise contraction mode and protein supplementa- tion on human skeletal muscle satellite cell content and muscle fiber growth. J Appl Physiol (1985) 117:898–909. https://doi. org/10.1152/japplphysiol.00261.2014
Farup J et al (2014b) Whey protein hydrolysate augments tendon and muscle hypertrophy independent of resistance exercise contrac- tion mode. Scand J Med Sci Sports 24:788–798. https://doi. org/10.1111/sms.12083
Faulkner JA, Opiteck JA, Brooks SV (1992) Injury to skeletal mus- cle during altitude training: induction and prevention. Int J Sports Med 13 Suppl 1:S160–S162. https://doi.org/10.105 5/s-2007-1024626
Flann KL, LaStayo PC, McClain DA, Hazel M, Lindstedt SL (2011) Muscle damage and muscle remodeling: no pain, no gain? J Exp Biol 214:674–679. https://doi.org/10.1242/jeb.050112
Foley JM, Jayaraman RC, Prior BM, Pivarnik JM, Meyer RA (1999) MR measurements of muscle damage and adaptation after eccen- tric exercise. J Appl Physiol (1985) 87:2311–2318
Folland JP, Williams AG (2007) The adaptations to strength train- ing: morphological and neurological contributions to increased strength. Sports Med 37:145–168
Folland JP, Chong J, Copeman EM, Jones DA (2001) Acute muscle damage as a stimulus for training-induced gains in strength. Med Sci Sports Exerc 33:1200–1205
Gibala MJ, MacDougall JD, Tarnopolsky MA, Stauber WT, Elorriaga A (1995) Changes in human skeletal muscle ultrastructure and force production after acute resistance exercise. J Appl Physiol (1985) 78:702–708
Gibala MJ, Interisano SA, Tarnopolsky MA, Roy BD, MacDonald JR, Yarasheski KE, MacDougall JD (2000) Myofibrillar disruption following acute concentric and eccentric resistance exercise in strength-trained men. Can J Physiol Pharmacol 78:656–661
Glynn EL, Fry CS, Drummond MJ, Dreyer HC, Dhanani S, Volpi E, Rasmussen BB (2010) Muscle protein breakdown has a minor role in the protein anabolic response to essential amino acid and carbohydrate intake following resistance exercise. Am J Phys- iol Regul Integr Comp Physiol 299:R533–R540. https://doi. org/10.1152/ajpregu.00077.2010
Gonzalez-Izal M, Lusa Cadore E, Izquierdo M (2014) Muscle con- duction velocity, surface electromyography variables, and echo intensity during concentric and eccentric fatigue. Muscle Nerve 49:389–397
Goreham C, Green HJ, Ball-Burnett M, Ranney D (1999) High-resist- ance training and muscle metabolism during prolonged exercise. Am J Physiol 276:E489–E496
Green H, Goreham C, Ouyang J, Ball-Burnett M, Ranney D (1999) Regulation of fiber size, oxidative potential, and capillariza- tion in human muscle by resistance exercise. Am J Physiol 276:R591–R596
Greenhaff PL et al (2008) Disassociation between the effects of amino acids and insulin on signaling, ubiquitin ligases, and protein turnover in human muscle. Am J Physiol Endocrinol Metab 295:E595–E604. https://doi.org/10.1152/ajpendo.90411.2008
Guerin CW, Holland PC (1995) Synthesis and secretion of matrix- degrading metalloproteases by human skeletal muscle sat- ellite cells. Dev Dyn 202:91–99. https://doi.org/10.1002/ aja.1002020109
Halkjaer-Kristensen J, Ingemann-Hansen T (1981) Variations in single fibre areas and fibre composition in needle biopsies from the human quadriceps muscle. Scand J Clin Lab Invest 41:391–395
Hess DR (2004) What is evidence-based medicine and why should I care? Respir Care 49:730–741
Hill JC, Millan IS (2014) Validation of musculoskeletal ultrasound to assess and quantify muscle glycogen content. A novel approach. Phys Sportsmed 42:45–52. https://doi.org/10.3810/ psm.2014.09.2075
Hortobagyi T, Hill JP, Houmard JA, Fraser DD, Lambert NJ, Israel RG (1996) Adaptive responses to muscle lengthening and shortening in humans. J Appl Physiol (1985) 80:765–772
Hough T (1900) Ergographic studies in muscular fatigue and soreness. J Boston Soc Med Sci 5:81–92
Hyldahl RD, Hubal MJ (2014) Lengthening our perspective: morpho- logical, cellular, and molecular responses to eccentric exercise. Muscle Nerve 49:155–170. https://doi.org/10.1002/mus.24077
Hyldahl RD, Olson T, Welling T, Groscost L, Parcell AC (2014) Satel- lite cell activity is differentially affected by contraction mode in human muscle following a work-matched bout of exercise. Front Physiol 5:485. https://doi.org/10.3389/fphys.2014.00485
Hyldahl RD et al (2015) Extracellular matrix remodeling and its con- tribution to protective adaptation following lengthening con- tractions in human muscle. FASEB J 29:2894–2904. https:// doi.org/10.1096/fj.14-266668
Jenkins ND et al (2016) Neuromuscular adaptations after 2 and 4 weeks of 80% versus 30% 1 repetition maximum resistance training to failure. J Strength Cond Res 30:2174–2185. https:// doi.org/10.1519/JSC.0000000000001308
Jenkins NDM, Miramonti AA, Hill EC, Smith CM, Cochrane-Sny- man KC, Housh TJ, Cramer JT (2017) Greater neural adapta- tions following high- vs. low-load resistance training. Front Physiol 8:331. https://doi.org/10.3389/fphys.2017.00331
Kadi F, Schjerling P, Andersen LL, Charifi N, Madsen JL, Chris- tensen LR, Andersen JL (2004) The effects of heavy resist- ance training and detraining on satellite cells in human skeletal muscles. J Physiol 558:1005–1012. https://doi.org/10.1113/ jphysiol.2004.065904
Kamen G, Knight CA (2004) Training-related adaptations in motor unit discharge rate in young and older adults. J Gerontol A Biol Sci Med Sci 59:1334–1338
Keefe G, Wright C (2016) An intricate balance of muscle damage and protein synthesis: the key players in skeletal muscle hyper- trophy following resistance training. J Physiol 594:7157–7158. https://doi.org/10.1113/JP273235
Kim PL, Staron RS, Phillips SM (2005) Fasted-state skeletal mus- cle protein synthesis after resistance exercise is altered with training. J Physiol 568:283–290. https://doi.org/10.1113/ jphysiol.2005.093708
Kumar V, Atherton P, Smith K, Rennie MJ (2009) Human muscle protein synthesis and breakdown during and after exercise. J Appl Physiol (1985) 106:2026–2039. https://doi.org/10.1152/ japplphysiol.91481.2008
Lauritzen F, Paulsen G, Raastad T, Bergersen LH, Owe SG (2009) Gross ultrastructural changes and necrotic fiber segments in elbow flexor muscles after maximal voluntary eccentric action in humans. J Appl Physiol (1985) 107:1923–1934. https://doi. org/10.1152/japplphysiol.00148.2009
Lepper C, Partridge TA, Fan CM (2011) An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development 138:3639–3646. https://doi. org/10.1242/dev.067595
Levels of Evidence (2009) Oxford Centre for Evidence-Based Medi- cine. http://www.cebm.net/oxford-centre-evidence-based-med- icine-levels-evidence-march-2009/. Accessed Mar 2009
Lixandrao ME et al (2014) Vastus lateralis muscle cross-sectional area ultrasonography validity for image fitting in humans. J Strength Cond Res 28:3293–3297. https://doi.org/10.1519/ JSC.0000000000000532
Lixandrao ME et al (2016) Time course of resistance training- induced muscle hypertrophy in the elderly. J Strength Cond Res 30:159–163. https://doi.org/10.1519/JSC.0000000000001019
Loenneke JP, Rossow LM, Fahs CA, Thiebaud RS, Grant Mouser J, Bemben MG (2017) Time-course of muscle growth, and its relationship with muscle strength in both young and older women. Geriatr Gerontol Int. https://doi.org/10.1111/ ggi.13010
Mackey AL, Andersen LL, Frandsen U, Sjogaard G (2011a) Strength training increases the size of the satellite cell pool in type I and II fibres of chronically painful trapezius muscle in females. J Physiol 589:5503–5515. https://doi.org/10.1113/ jphysiol.2011.217885
Mackey AL et al (2011b) Sequenced response of extracellular matrix deadhesion and fibrotic regulators after muscle damage is involved in protection against future injury in human skel- etal muscle. FASEB J 25:1943–1959. https://doi.org/10.1096/ fj.10-176487
Mackey AL, Holm L, Reitelseder S, Pedersen TG, Doessing S, Kadi F, Kjaer M (2011c) Myogenic response of human skel- etal muscle to 12 weeks of resistance training at light loading intensity. Scand J Med Sci Sports 21:773–782. https://doi. org/10.1111/j.1600-0838.2010.01178.x
Mahon M, Toman A, Willan PL, Bagnall KM (1984) Variability of histochemical and morphometric data from needle biopsy specimens of human quadriceps femoris muscle. J Neurol Sci 63:85–100
Malm C, Sjodin TL, Sjoberg B, Lenkei R, Renstrom P, Lundberg IE, Ekblom B (2004) Leukocytes, cytokines, growth factors and hor- mones in human skeletal muscle and blood after uphill or down- hill running. J Physiol 556:983–1000. https://doi.org/10.1113/ jphysiol.2003.056598
Mauro A (1961) Satellite cell of skeletal muscle fibers. J Biophys Bio- chem Cytol 9:493–495
Mayhew DL, Kim JS, Cross JM, Ferrando AA, Bamman MM (2009) Translational signaling responses preceding resistance training- mediated myofiber hypertrophy in young and old humans. J Appl Physiol (1985) 107:1655–1662. https://doi.org/10.1152/ japplphysiol.91234.2008
McCarthy JJ, Esser KA (2007) Counterpoint: satellite cell addi- tion is not obligatory for skeletal muscle hypertrophy. J Appl Physiol (1985) 103:1100–1102. https://doi.org/10.1152/ japplphysiol.00101.2007a (discussion 1102–1103)
McCarthy JJ, Dupont-Versteegden EE, Fry CS, Murach KA, Peterson CA (2017) Methodological issues limit interpretation of nega- tive effects of satellite cell depletion on adult muscle hyper- trophy. Development 144:1363–1365. https://doi.org/10.1242/ dev.145797
McKay BR, O’Reilly CE, Phillips SM, Tarnopolsky MA, Parise G (2008) Co-expression of IGF-1 family members with myogenic regulatory factors following acute damaging muscle-lengthening contractions in humans. J Physiol 586:5549–5560. https://doi. org/10.1113/jphysiol.2008.160176
McKay BR, De Lisio M, Johnston AP, O’Reilly CE, Phillips SM, Tarnopolsky MA, Parise G (2009) Association of interleukin-6 signalling with the muscle stem cell response following muscle- lengthening contractions in humans. PLoS One 4:e6027. https:// doi.org/10.1371/journal.pone.0006027
McKay BR, Toth KG, Tarnopolsky MA, Parise G (2010) Satellite cell number and cell cycle kinetics in response to acute myotrauma in humans: immunohistochemistry versus flow cytometry. J Physiol 588:3307–3320. https://doi.org/10.1113/jphysiol.2010.190876
McKeon PO, Medina JM, Hertel J (2006) Hierarchy of research design in evidence-based sports medicine. Int J Athl Ther Train 11:42–45
Mitchell CJ et al (2014) Acute post-exercise myofibrillar protein syn- thesis is not correlated with resistance training-induced muscle hypertrophy in young men. PLoS One 9:e89431. https://doi. org/10.1371/journal.pone.0089431
Mitchell CJ, Churchward-Venne TA, Cameron-Smith D, Phillips SM (2015) What is the relationship between the acute mus- cle protein synthesis response and changes in muscle mass? J Appl Physiol (1985) 118:495–497. https://doi.org/10.1152/ japplphysiol.00609.2014
Moore DR, Phillips SM, Babraj JA, Smith K, Rennie MJ (2005) Myofi- brillar and collagen protein synthesis in human skeletal muscle in young men after maximal shortening and lengthening con- tractions. Am J Physiol Endocrinol Metab 288:E1153–E1159. https://doi.org/10.1152/ajpendo.00387.2004
Moore DR, Tang JE, Burd NA, Rerecich T, Tarnopolsky MA, Phil- lips SM (2009) Differential stimulation of myofibrillar and sar- coplasmic protein synthesis with protein ingestion at rest and after resistance exercise. J Physiol 587:897–904. https://doi. org/10.1113/jphysiol.2008.164087
Moore DR, Young M, Phillips SM (2012) Similar increases in muscle size and strength in young men after training with maximal short- ening or lengthening contractions when matched for total work. Eur J Appl Physiol 112:1587–1592. https://doi.org/10.1007/ s00421-011-2078-x
Moritani T, deVries HA (1979) Neural factors versus hypertrophy in the time course of muscle strength gain. Am J Phys Med 58:115–130
Murphy MM, Lawson JA, Mathew SJ, Hutcheson DA, Kardon G (2011) Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development 138:3625–3637. https://doi.org/10.1242/dev.064162
Murphy-Ullrich JE (2001) The de-adhesive activity of matricellular proteins: is intermediate cell adhesion an adaptive state? J Clin Invest 107:785–790. https://doi.org/10.1172/JCI12609
Nederveen JP et al (2017) Altered muscle satellite cell activation following 16 week of resistance training in young men. Am J Physiol Regul Integr Comp Physiol 312:R85-R92. https://doi. org/10.1152/ajpregu.00221.2016
Newton MJ, Morgan GT, Sacco P, Chapman DW, Nosaka K (2008) Comparison of responses to strenuous eccentric exercise of the elbow flexors between resistance-trained and untrained men. J Strength Cond Res 22:597–607. https://doi.org/10.1519/ JSC.0b013e3181660003
Nosaka K, Clarkson PM (1996) Changes in indicators of inflammation after eccentric exercise of the elbow flexors. Med Sci Sports Exerc 28:953–961
Nosaka K, Newton M (2002) Concentric or eccentric training effect on eccentric exercise-induced muscle damage. Med Sci Sports Exerc 34:63–69
Nosaka K, Sakamoto K (2001) Effect of elbow joint angle on the mag- nitude of muscle damage to the elbow flexors. Med Sci Sports Exerc 33:22–29
Nosaka K, Clarkson PM, McGuiggin ME, Byrne JM (1991) Time course of muscle adaptation after high force eccentric exercise. Eur J Appl Physiol Occup Physiol 63:70–76
Nosaka K, Newton M, Sacco P (2002) Delayed-onset muscle soreness does not reflect the magnitude of eccentric exercise-induced mus- cle damage. Scand J Med Sci Sports 12:337–346
Nosaka K, Lavender A, Newton M, Sacco P (2003) Muscle damage in resistance training—is muscle damage necessary for strength gain and muscle hypertrophy? Int J Sport Health Sci 1:1–8
Nosaka K, Newton MJ, Sacco P (2005) Attenuation of protective effect against eccentric exercise-induced muscle damage. Can J Appl Physiol 30:529–542
O’Connor RS, Pavlath GK (2007) Point:counterpoint: satellite cell addition is/is not obligatory for skeletal muscle hypertrophy. J Appl Physiol (1985) 103:1099–1100. https://doi.org/10.1152/ japplphysiol.00101.2007
O’Reilly C, McKay B, Phillips S, Tarnopolsky M, Parise G (2008) Hepatocyte growth factor (HGF) and the satellite cell response following muscle lengthening contractions in humans. Muscle Nerve 38:1434–1442. https://doi.org/10.1002/mus.21146
Palecek SP, Loftus JC, Ginsberg MH, Lauffenburger DA, Horwitz AF (1997) Integrin-ligand binding properties govern cell migration speed through cell-substratum adhesiveness. Nature 385:537– 540. https://doi.org/10.1038/385537a0
Paulsen G, Mikkelsen UR, Raastad T, Peake JM (2012) Leucocytes, cytokines and satellite cells: what role do they play in muscle damage and regeneration following eccentric exercise? Exerc Immunol Rev 18:42–97
Peake J, Nosaka K, Suzuki K (2005) Characterization of inflammatory responses to eccentric exercise in humans. Exerc Immunol Rev 11:64–85
Petrella JK, Kim JS, Cross JM, Kosek DJ, Bamman MM (2006) Effi- cacy of myonuclear addition may explain differential myofiber growth among resistance-trained young and older men and women. Am J Physiol Endocrinol Metab 291:E937–E946. https://doi. org/10.1152/ajpendo.00190.2006
Petrella JK, Kim JS, Mayhew DL, Cross JM, Bamman MM (2008) Potent myofiber hypertrophy during resistance training in humans is associated with satellite cell-mediated myonuclear addition: a cluster analysis. J Appl Physiol (1985) 104:1736–1742. https://doi. org/10.1152/japplphysiol.01215.2007
Phillips SM, Tipton KD, Aarsland A, Wolf SE, Wolfe RR (1997) Mixed muscle protein synthesis and breakdown after resistance exercise in humans. Am J Physiol 273:E99–E107
Phillips SM, Tipton KD, Ferrando AA, Wolfe RR (1999) Resistance training reduces the acute exercise-induced increase in muscle protein turnover. Am J Physiol 276:E118–E124
Phillips SM, Parise G, Roy BD, Tipton KD, Wolfe RR, Tamopolsky MA (2002) Resistance-training-induced adaptations in skeletal muscle protein turnover in the fed state. Can J Physiol Pharmacol 80:1045–1053
Phillips BE, Hill DS, Atherton PJ (2012) Regulation of muscle protein synthesis in humans. Curr Opin Clin Nutr Metab Care 15:58–63. https://doi.org/10.1097/MCO.0b013e32834d19bc
Pillen S et al (2009) Skeletal muscle ultrasound: correlation between fibrous tissue and echo intensity. Ultrasound Med Biol 35:443–446. https://doi.org/10.1016/j.ultrasmedbio.2008.09.016
Proske U, Morgan DL (2001) Muscle damage from eccentric exercise: mechanism, mechanical signs, adaptation and clinical applications. J Physiol 537:333–345
Puddy RW, Wilkins N (2011) Understanding evidence Part 1: best avail- able research evidence. A Guide to the Continuum of Evidence of Efectiveness, Atlanta
Raastad T et al (2010) Changes in calpain activity, muscle structure, and function after eccentric exercise. Med Sci Sports Exerc 42:86–95 Rahbek SK, Farup J, Moller AB, Vendelbo MH, Holm L, Jessen N, Viss-
ing K (2014) Effects of divergent resistance exercise contraction mode and dietary supplementation type on anabolic signalling, muscle protein synthesis and muscle hypertrophy. Amino Acids 46:2377–2392. https://doi.org/10.1007/s00726-014-1792-1
Rosenberg JG, Ryan ED, Sobolewski EJ, Scharville MJ, Thompson BJ, King GE (2014) Reliability of panoramic ultrasound imaging to simultaneously examine muscle size and quality of the medial gas- trocnemius. Muscle Nerve 49:736–740. https://doi.org/10.1002/ mus.24061
Sale DG (1988) Neural adaptation to resistance training. Med Sci Sports Exerc 20:S135–S145
Sambasivan R et al (2011) Pax7-expressing satellite cells are indispensa- ble for adult skeletal muscle regeneration. Development 138:3647– 3656. https://doi.org/10.1242/dev.067587
Sayers SP, Clarkson PM (2001) Force recovery after eccentric exercise in males and females. Eur J Appl Physiol 84:122–126. https://doi. org/10.1007/s004210000346
Schoenfeld BJ, Ogborn DI, Vigotsky AD, Franchi MV, Krieger JW (2017) Hypertrophic effects of concentric vs. eccentric muscle actions: a systematic review and meta-analysis. J Strength Cond Res 31:2599–2608. https://doi.org/10.1519/JSC.0000000000001983
Seynnes OR, de Boer M, Narici MV (2007) Early skeletal muscle hyper- trophy and architectural changes in response to high-intensity resistance training. J Appl Physiol (1985) 102:368–373. https:// doi.org/10.1152/japplphysiol.00789.2006
Shepstone TN, Tang JE, Dallaire S, Schuenke MD, Staron RS, Phillips SM (2005) Short-term high- vs. low-velocity isokinetic lengthening training results in greater hypertrophy of the elbow flexors in young men. J Appl Physiol (1985) 98:1768–1776. https://doi.org/10.1152/ japplphysiol.01027.2004
Smeuninx B, McKendry J (2016) Mechanisms of resistance exercise- induced muscle hypertrophy: ‘You can’t make an omelette without breaking eggs’. J Physiol 594:7159–7160. https://doi.org/10.1113/ JP273343
Smith LL, Anwar A, Fragen M, Rananto C, Johnson R, Holbert D (2000) Cytokines and cell adhesion molecules associated with high-inten- sity eccentric exercise. Eur J Appl Physiol 82:61–67. https://doi. org/10.1007/s004210050652
Snijders T, Smeets JS, van Kranenburg J, Kies AK, van Loon LJ, Verdijk LB (2016) Changes in myonuclear domain size do not precede muscle hypertrophy during prolonged resistance-type exercise training. Acta Physiol (Oxf) 216:231–239. https://doi.org/10.1111/ apha.12609
Sorichter S, Puschendorf B, Mair J (1999) Skeletal muscle injury induced by eccentric muscle action: muscle proteins as markers of muscle fiber injury. Exerc Immunol Rev 5:5–21
Stock MS et al (2017) The time course of short-term hypertrophy in the absence of eccentric muscle damage. Eur J Appl Physiol 117:989– 1004. https://doi.org/10.1007/s00421-017-3587-z
Tang JE, Perco JG, Moore DR, Wilkinson SB, Phillips SM (2008) Resist- ance training alters the response of fed state mixed muscle protein synthesis in young men. Am J Physiol Regul Integr Comp Physiol 294:R172–R178. https://doi.org/10.1152/ajpregu.00636.2007
Tesch P (1980) Muscle fatigue in man. With special reference to lac- tate accumulation during short term intense exercise. Acta Physiol Scand Suppl 480:1–40
Twist C, Eston RG (2009) The effect of exercise-induced muscle dam- age on perceived exertion and cycling endurance performance. Eur J Appl Physiol 105:559–567. https://doi.org/10.1007/ s00421-008-0935-z
Wang YX, Rudnicki MA (2011) Satellite cells, the engines of muscle repair. Nat Rev Mol Cell Biol 13:127–133. https://doi.org/10.1038/ nrm3265
Warren GL, Lowe DA, Armstrong RB (1999) Measurement tools used in the study of eccentric contraction-induced injury. Sports Med 27:43–59
Warren GL, Ingalls CP, Lowe DA, Armstrong RB (2002) What mecha- nisms contribute to the strength loss that occurs during and in the recovery from skeletal muscle injury? J Orthop Sports Phys Ther 32:58–64. https://doi.org/10.2519/jospt.2002.32.2.58
Wernbom M, Augustsson J, Thomee R (2007) The influence of fre- quency, intensity, volume and mode of strength training on whole muscle cross-sectional area in humans. Sports Med 37:225–264
Wilkinson SB, Phillips SM, Atherton PJ, Patel R, Yarasheski KE, Tar- nopolsky MA, Rennie MJ (2008) Differential effects of resistance and endurance exercise in the fed state on signalling molecule phosphorylation and protein synthesis in human muscle. J Physiol 586:3701–3717. https://doi.org/10.1113/jphysiol.2008.153916
Young A, Hughes I, Round JM, Edwards RH (1982) The effect of knee injury on the number of muscle fibres in the human quadriceps femoris. Clin Sci (Lond) 62:227–234
Yu JG, Carlsson L, Thornell LE (2004) Evidence for myofibril remod- eling as opposed to myofibril damage in human muscles with DOMS: an ultrastructural and immunoelectron microscopic study. Histochem Cell Biol 121:219–227. https://doi.org/10.1007/ s00418-004-0625-9
Zammit PS, Golding JP, Nagata Y, Hudon V, Partridge TA, Beauchamp JR (2004) Muscle satellite cells adopt divergent fates: a mechanism for self-renewal? J Cell Biol 166:347–357. https://doi.org/10.1083/ jcb.200312007
Zong H, Ren JM, Young LH, Pypaert M, Mu J, Birnbaum MJ, Shulman GI (2002) AMP kinase is required for mitochondrial biogenesis in skeletal muscle in response to chronic energy deprivation. Proc Natl Acad Sci USA 99:15983–15987. https://doi.org/10.1073/ pnas.252625599



 L’hypertrophie musculaire par l’intermédiaire du renforcement : rôle des dommages musculaires et de la synthèse de protéines musculaire
L’hypertrophie musculaire par l’intermédiaire du renforcement : rôle des dommages musculaires et de la synthèse de protéines musculaire



